1达斯汀M.格雷厄姆和2、3Kwoon y黄
1自然出版集团,纽约,纽约。
2密歇根大学分子、细胞与发育生物学系,眼科学与视觉科学系,密歇根安娜堡48105。
3.函授:kwoon@umich.edu
1.介绍。
在过去150年的大部分时间里,人们认为哺乳动物的视网膜只包含两类感光细胞:视杆细胞和视锥细胞。然而,20世纪90年代末和21世纪初的一系列研究证明了第三类哺乳动物光感受器的存在,它们与视杆细胞和视锥细胞有很大的不同。它利用了一种不同的光颜料,对光的敏感度要低得多,对光的反应要慢得多,空间分辨率也低得多,这些特征与它向大脑发送环境光水平(辐射度)信号的主要功能相符合。最令人惊讶的是,这些光感受器是视网膜神经节细胞(RGCs),因此,具有与大脑高级视觉中枢直接交流的独特能力。这些本质光敏的视网膜神经节细胞(ipRGCs)是神经节细胞中罕见的亚群(<5%),其主要作用是为很大程度上潜意识的、非图像形成的视觉反射发出光信号,如瞳孔收缩、神经内分泌调节和将每日(“昼夜节律”)生理节律同步到明暗周期(“昼夜光诱带”)。最近的研究揭示了ipRGCs在有意识视觉感知中的其他作用,包括亮度辨别和对比检测。许多在ipRGC控制下的视觉行为是显著的增强性的,需要环境光水平的长期整合。iprgc的独特特性使它们非常适合调节这种行为。
2.历史和发现。
1923年,作为一名研究生,Clyde Keeler对患有严重视网膜外变性的小鼠进行了一系列有趣的观察(Keeler, 1928;Van Gelder, 2008)。尽管这些小鼠缺乏大部分的杆状和锥状感光细胞,被认为是功能性失明,但它们仍然能够收缩瞳孔以响应光线(Keeler, 1927),这导致Keeler推断,视网膜中一定潜伏着一些其他的感光细胞。但是,对这些瞳孔反射的另一种更简单的解释是,它们是由为数不多的存活的锥体光感受器驱动的,因此,非杆状非锥体光感受器的存在仍然不确定。七十年后,Russell Foster和他的同事设计了缺少所有杆状体和锥状体的小鼠,这些小鼠不仅表现出了强健的瞳孔光反射,而且还保持了根据变化的光周期改变昼夜节律的能力,并在响应光脉冲时抑制夜间松果体褪黑激素的分泌(Freedman, 1999;卢卡斯,1999)。然而,当动物的眼睛被摘除后,这些过程就消失了,这有力地支持了基勒关于一种新型眼部感光器的预测(Klein, 1972)。但直到一种新的光敏分子(视蛋白)的发现,从一个不太可能的来源,基勒的预测才被证明是正确的。
Iggy Provencio及其同事在研究青蛙的光敏皮肤细胞(“真皮黑色素”)时,克隆了一种新的视蛋白样分子,他们认为这种分子负责皮肤色素在对光的反应下的重新分配(Provencio, 1998)。Provencio等人称之为黑视素的这种假定视蛋白的同源物也被发现在小鼠(图1A)和人类视网膜的一小部分rgc中表达(Provencio, 1998;Provencio, 2000;Provencio, 2002)和其他研究发现,含有黑素的细胞将它们的轴突发送到视交叉上核(SCN),哺乳动物的中央昼夜节律时钟的位置(Gooley, 2001;汉尼拔,2002)。
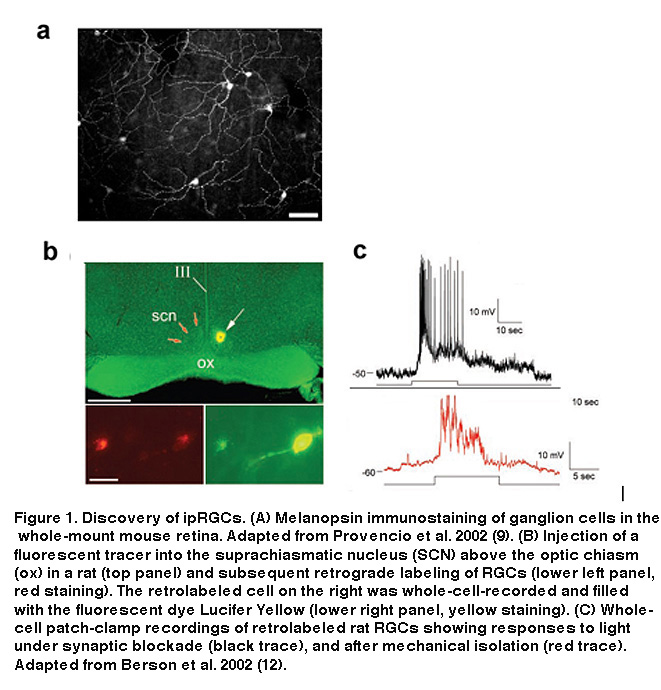
这些发现表明,这些rgc可能是基勒在近80年前预测的神秘的第三种光感受器类型。它们表达一种假设的视蛋白,可能使它们直接对光线做出反应,并向一个大脑目标发送轴突投影,已知与无杆/无锥体小鼠的两种视觉反射有关,即昼夜光夹带和松果体褪黑激素释放的光抑制。然而,这些含有黑视素的、投射scn的rgc能够直接感知光线的确切证据仍然缺乏。David Berson和他的同事结合电生理学向SCN注射示迹剂,验证了SCN投射的rgc是光敏感的假设。他们对由示踪剂逆行标记的rgc进行了全细胞记录(图1B),发现这些细胞确实能够在鸡尾酒药物存在的情况下对光做出反应,消除了视网膜中的所有杆状和锥状信号(图1C),前) (Berson, 2002)。即使在与视网膜的其余部分机械分离后,这些细胞仍然具有光敏性(图1C,底),消除了所有对标记的rgc是真正的光感受器的怀疑(Berson, 2002)。全细胞记录后进行的免疫组化证实了这些scn投射细胞中存在黑视素(Hattar, 2002)。这些scn投射的iprgc的形态和分布如图2所示。
3.黑视素。
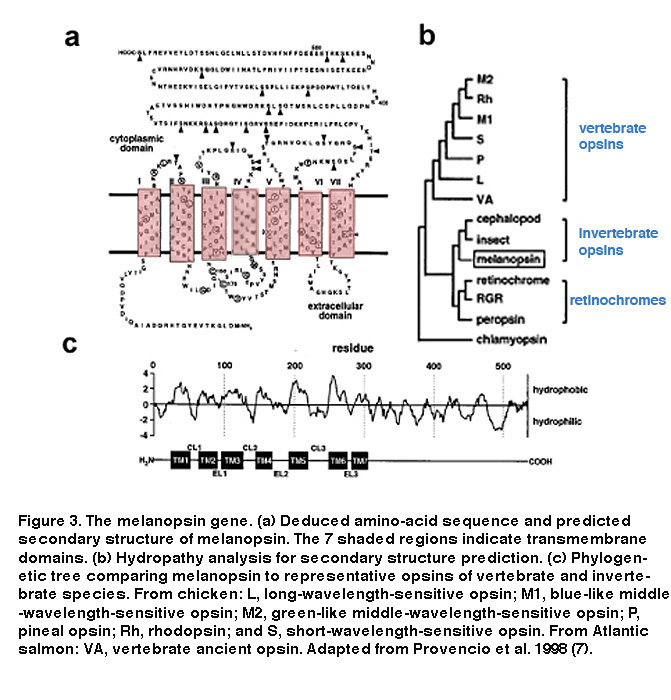
我们现在知道,iprgc直接对光做出反应的能力确实是由于它们的黑视素的表达。黑视素基因(opn4)已在许多哺乳动物物种中被发现,例如老鼠、猴子和人类(Provencio, 2000)。黑素旋转蛋白氨基酸序列的疏水性分析预测了一个7跨膜结构,是所有G蛋白偶联受体的共同结构(图3A, B) (Provencio, 1998)。有趣的是,黑视蛋白与无脊椎动物光感受器的横纹肌视蛋白(r-视蛋白)的同源性高于与脊椎动物光感受器的纤毛视蛋白(c-视蛋白)的同源性,这表明黑视蛋白可以通过一种不同于脊椎动物视杆和视锥细胞的光转导机制发出光信号(图3C) (Provencio, 1998)(见下面的“光转导”)。
尽管对ipRGCs的最初研究表明黑视蛋白是这些细胞中的光色素,但最初不能排除一组被称为隐色素的吸收蓝光的黄蛋白的作用(Berson, 2007)。隐色素在植物和无脊椎动物中起着光色素的作用,早期的研究倾向于它们在哺乳动物昼夜节律系统中作为视网膜光色素的作用(Kavakli, 2002;凡德,2002)。然而,后续的工作提供了压倒性的证据,黑视素是ipRGCs的光色素。当通过转基因技术在小鼠(“黑视素敲除小鼠”)中删除黑视素基因时,从SCN逆行标记的rgc不再对光直接产生反应(Lucas, 2003)。此外,缺少黑视素基因的动物显示出多种视觉反射的缺陷,如瞳孔收缩和光夹带(Panda, 2003;熊猫,2002;Ruby, 2002;卢卡斯,2003;Hattar, 2003)。 Despite this evidence, there were still controversies regarding melanopsin’s ability to function as a photopigment. For example, it remained possible that melanopsin is not the ipRGC photopigment, but is instead an isomerase essential for the proper functioning of the ipRGC photopigment. These doubts were firmly extinguished with a series of experiments whereby the melanopsin gene was heterologously expressed in multiple cell types that are normally insensitive to light. When made to express melanopsin, these cells were able to robustly respond to light, indicating melanopsin’s ability to function as a bona fide photopigment (Melyan, 2005; Panda, 2005; Qiu, 2005).
4.Phototransduction
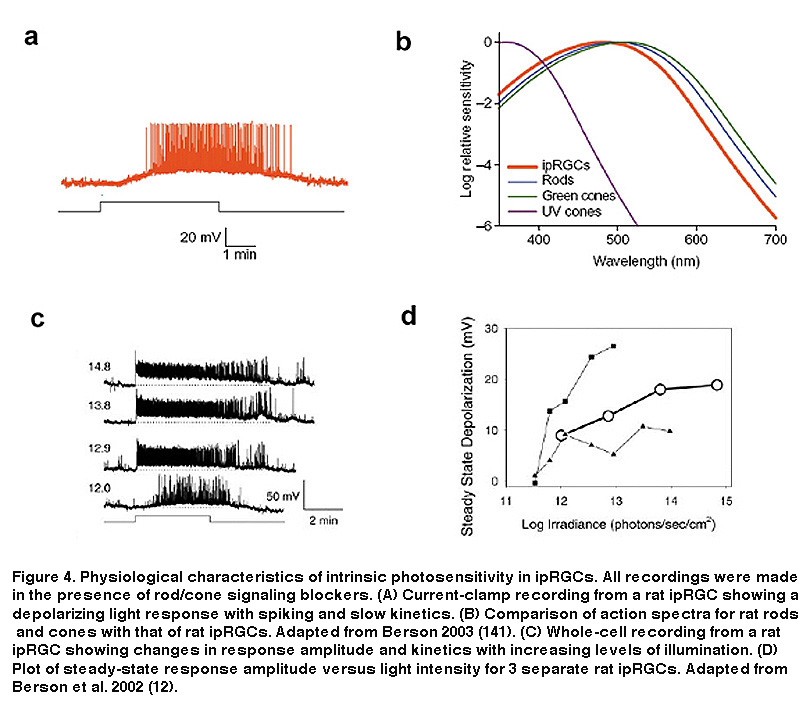
如图4所示,ipRGCs的固有光响应与杆状体和锥状体有显著差异。最值得注意的是响应极性的差异:iprgc的直接光响应是去偏光的,而杆状和锥状细胞对光超偏光。此外,与经典的光感受器相比,iprgc对光的敏感性要低得多,信号的动力学也慢得多(图4A) (Berson, 2002;做,2009)。iprgc还能够对光产生非常持久的反应,在相对较长的时间内忠实地编码刺激能量(图4C)。这一特性将iprgc与所有其他哺乳动物的rgc区别开来,后者不能以这种方式稳定地表示环境光水平(Wong, 2007;黄,2012;巴洛,1969)。ipRGC生理学的另一个显著特征是它们的树突(含有黑视素)直接对光做出反应的能力(Berson, 2002)。结合它们巨大的重叠树突状场,整个ipRGC种群形成了Provencio和同事们所说的“光接受网”(Provencio, 2002)。 These characteristics of ipRGCs are no doubt tailored to their role in signaling diffuse ambient light levels over many hours for tonic, non-image-forming visual behaviors such as photoentrainment and pupillary reflex. A further distinction of ipRGCs is their action spectrum (i.e. wavelength-sensitivity function), due to the utilization of melanopsin as their photopigment. IpRGC photoreception is most sensitive to light at around 480 nm (Berson, 2002; Dacey, 2005; Tu, 2005), significantly different (≥20 nm) from the best wavelengths for stimulating rods and cones (Figure 4B).
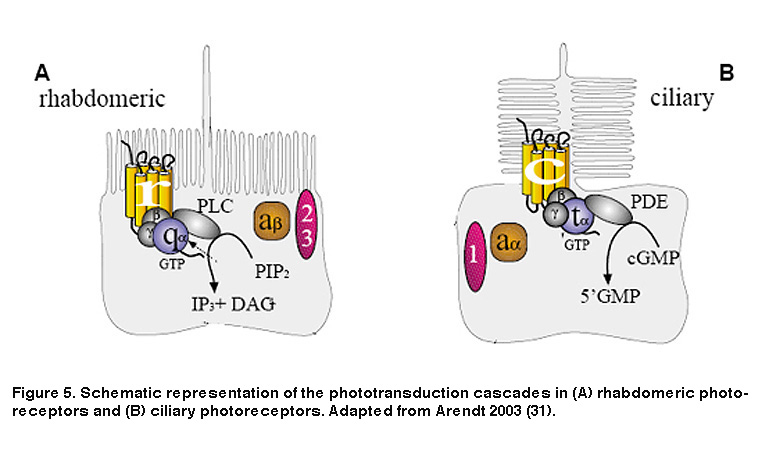
如前所述,动物光感受器有两种基本类型:横纹肌(主要存在于无脊椎动物中)和纤毛(脊椎动物的杆状和锥状最显著)。横纹肌光感受器和纤毛光感受器的一个显著特征是,这两种细胞都使用不同的生化级联将光能转化为大脑可以解释的电信号。杆状体和锥状体使用包括环单磷酸鸟苷(cGMP)的级联作为第二个信使(图5B) (Arendt, 2003;傅,2007)。对光的反应是cGMP水平下降,关闭cGMP门控阳离子通道,导致质膜超极化。这与横纹肌光感受器形成鲜明对比,横纹肌光感受器使用磷酸肌醇信号级联,涉及磷脂酶C (PLC)和膜脂磷脂酰肌醇二磷酸(PIP2)的分解(图5A),导致阳离子通道的打开和膜去极化(Hardie, 2001;难的,2001)。此外,虽然两种光转导级联都是由G蛋白介导的,但所需要的G蛋白的特异性是不同的。纤毛光感受器需要转导蛋白,这是G蛋白的Gi/o家族成员,而横纹肌光感受器使用的是Gq/11家族的G蛋白(图5)。
图5所示。的光转导级联示意图(一个)横纹肌光感受器及(B纤毛细胞。改编自阿伦特2003年。
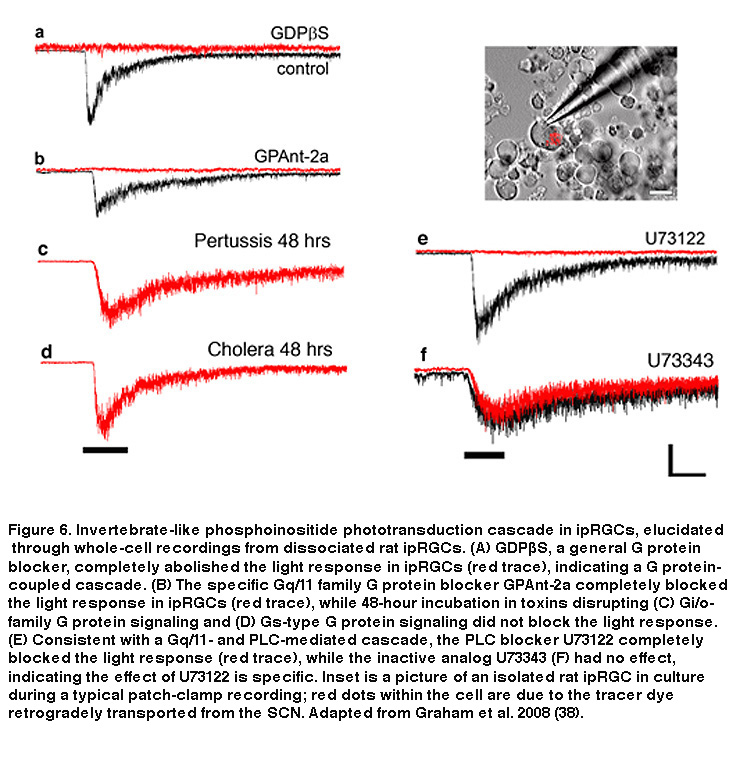
就像杆状和锥状光色素一样,黑视蛋白也使用11-cis -视网膜作为吸光发色团,光诱导异构化11-cis -视网膜,all-trans-视网膜是光转导过程的第一步(Walker, 2008;傅,2005)。然而,黑视蛋白与无脊椎视蛋白的高度同源性,以及ipRGCs的去极化内在光响应,表明这些神经元可能使用一种不同于杆状和锥状纤毛级联的横纹肌光转导级联。早期的ipRGCs药理研究不能证实这一假设,最有可能的原因是采用了全安装视网膜制备。深埋于内丛状层(IPL,在IPL中,双极细胞、无分泌细胞和神经节细胞之间形成突触)的光敏ipRGC树突和覆盖视网膜表面的胶质膜鞘的结合,为药理学药物,特别是通常用于研究转导机制的疏水药物,创造了一个重要的扩散屏障。为了克服这一障碍,David Berson和他的同事记录了机械分离的ipRGC体细胞,以方便药物学操作。分离的iprgc在培养中存活非常好,产生强烈的光反应可达6天。利用该系统,Berson等人展示了ipRGC光转导利用横纹肌样磷酸肌苷级联,需要G蛋白的Gq/11家族成员(或可能成员)和效应酶磷脂酶C (PLC)(图6)(Graham, 2008)(但见(Chew, 2014))。此外,通过单细胞RT-PCR和免疫细胞化学,在ipRGCs中确认了特异性Gq/11和PLC亚型的存在,这与药理学研究结果一致(Graham, 2008)。从基因上敲除PLC的β4亚型几乎消除了ipRGCs的固有光响应(Xue, 2011)。
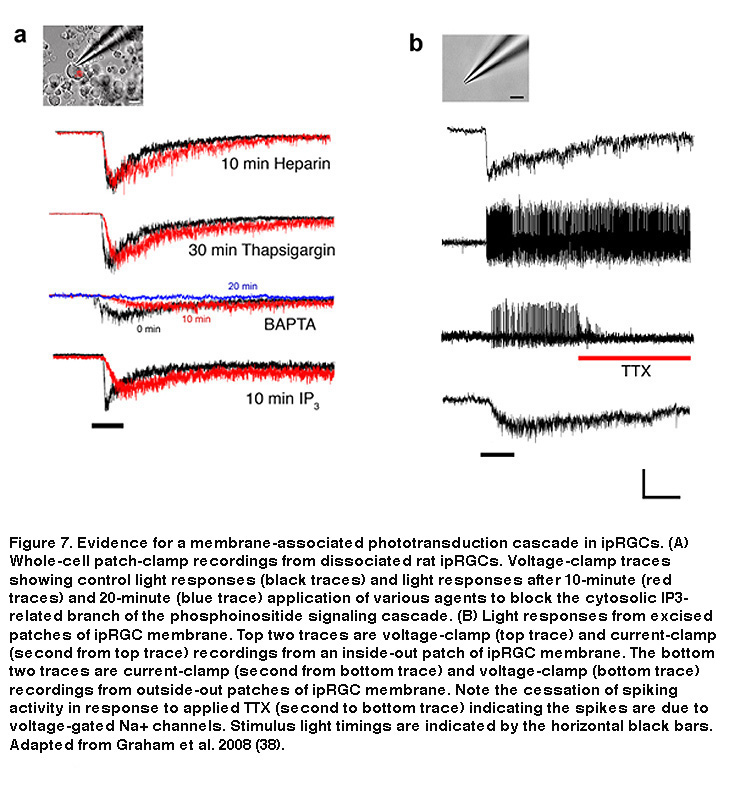
在横纹肌光感受器中,PIP2被PLC分解产生两种副产物:一种叫做二酰基甘油(DAG)的膜结合成分和三磷酸肌醇(IP3), IP3可以在细胞质中自由移动(Hardie, 2001)。DAG可以在细胞膜内被分解为多不饱和脂肪酸(PUFAs),这已被证明直接打开果蝇光感受器的瞬时受体电位(TRP)通道(Chyb, 1999)。另一方面,IP3可引起Ca的释放2 +从细胞内储存,这可以导致打开所谓的“储存操作通道”在质膜。在果蝇的光感受器中,将PIP2的分解与色氨酸通道打开连接起来的下游机制尚不清楚,尽管可能存在膜相关途径(Acharya, 1997)。在iprgc中,光门控阳离子通道也是TRP通道,具体来说,是TRPM6和TRPM7 (Xue, 2011),数据强烈表明,细胞内的IP3通路并不是光转导所必需的,与果蝇光感受器类似(图7)(Graham, 2008)。高浓度IP3在细胞内的应用既没有诱导电流,也没有阻断ipRGCs的光反应(图7A),尽管它确实调节了某些响应特性,表明IP3和细胞内Ca起着非必要的次要作用2 +.同样,ipRGC光转导在IP3受体被细胞内肝素或细胞内Ca阻断后仍然存活2 +使用thapsigargin存储损耗(图7A)。只有在长时间暴露在非常高(10mM)浓度的一般Ca2 +尽管这可能是夹紧静止的细胞内钙的副作用,但人们是否发现光转导的显著衰减(Graham, 2008)2 +水平低到像PLC这样的酶不再能够发挥作用(Hardie, 2005)。ipRGC光转导不需要胞质IP3分支的最令人信服的证据是,ipRGC膜的切除补丁(由外向外和由内向外)仍然具有自主光敏性(图7B),排除了高度扩散的胞质成分的重要作用(Graham, 2008)。基于这些发现,ipRGC光转导的所有必要成分似乎都在质膜内,或与质膜紧密耦合。
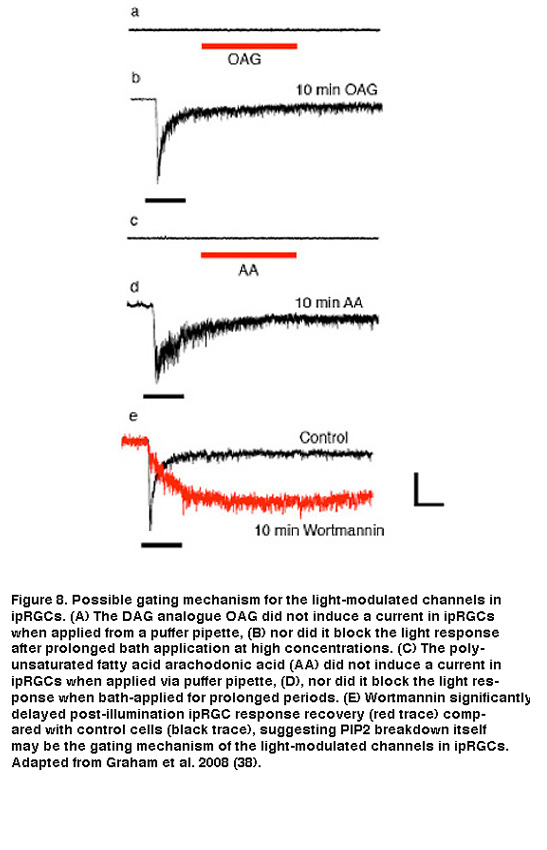
PLC激活下游的确切通道门控机制尚不清楚。应用DAG或PUFAs,无论是对分离的ipRGC胞体还是对ipRGC膜的切除块,都不能引起电流或阻挡光响应(图8A-D)。另一种假说与膜相关的转导级联一致,即PIP2本身的分解(与DAG或PUFAs的产生相反)是打开iprgc中光门控色氨酸通道的关键信号。有证据表明,PIP2可以打开或关闭多种离子通道,包括果蝇光感受器中的光门控通道(Hardie, 2003;Suh, 2006)。作为这一假设的初步检验,Berson等人使用渥曼宁在药理学上干扰了PIP2的合成。该药抑制磷酸肌醇4-激酶(PI4-K), PI4-K是磷脂酰肌醇4-磷酸(PIP)的合成酶,PIP是PIP2的重要前体。根据假设,wortmannin应该通过延迟PIP2静息水平的恢复,从而延迟光门控通道的关闭,来减缓光偏移处光电流的终止。事实上,当记录移液管溶液中加入wortmannin时,反应关闭显著延迟(图8E)。然而,还需要进一步和更直接的证据来解决iprgc中光调制通道的门控机制。
曝光后,all-trans视网膜在杆状、锥体或ipRGC光色素必须异构化回11-cis-视网膜使光色素再次光兴奋(哈伯德,1958)。对于视紫红质来说,这种再异构化需要相邻的视网膜色素上皮(RPE),而锥色素除了依赖RPE外,还依赖Müller胶质细胞(Wang, 2011)。相反,光激发的黑视素似乎保留all-trans-视网膜异构化11-cis-视网膜在随后的光子吸收,这一过程称为光逆转(Mure, 2007;伊曼纽尔,2015;森野奎,2005;戴维斯,2011;松山,2012)。因此,黑视蛋白可以同时作为光色素和光异构酶,类似于一些无脊椎动物的光色素,当RPE酶合成时,ipRGCs仍然直接光敏11-cis-视网膜在基因或药物上受到抑制(Doyle, 2006;你,2006)。然而,如果没有这些酶,ipRGCs基于黑视素的光响应减弱,这表明黑视素功能在一定程度上依赖于RPE (Fu, 2005;赵,2016).
5.突触输入
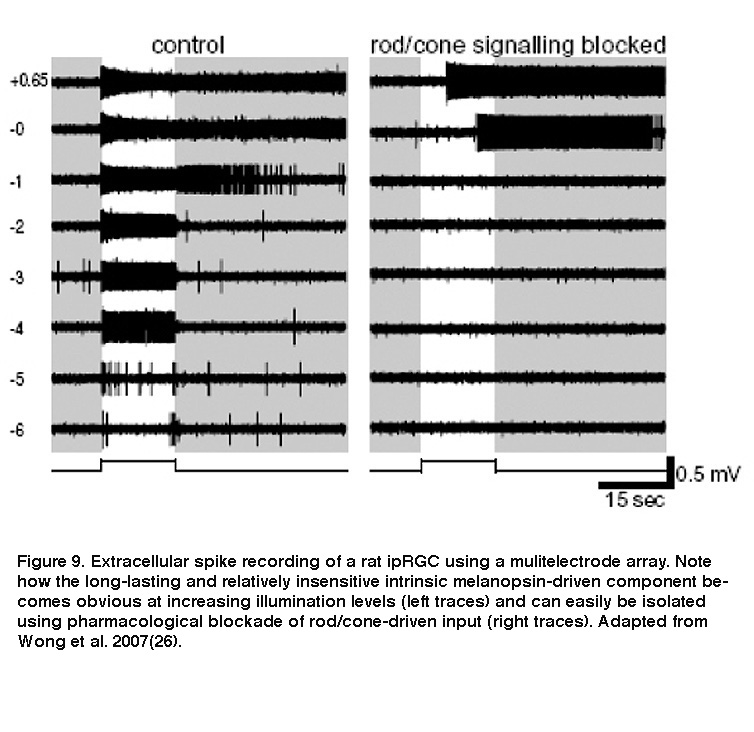
虽然ipRGCs可以作为光感受器,但它们仍然从杆/锥驱动电路接收视网膜内的突触输入。电子显微镜显示,在IPL中,无分泌细胞和双极细胞对黑素免疫阳性过程的突触接触(Belenky, 2003)。因此,iprgc对光的反应不仅直接通过黑视素,也间接通过突触介导的来自杆状细胞和锥状细胞的输入(Dacey, 2005;Perez-Leon, 2006;黄,2007;赵,2014;翁,2013)。内部光响应和外部的杆/锥驱动光响应都具有显著的强韧性,可以连续发出光信号至少10小时(Wong, 2012)。此外,两个响应分量的接受场与每个ipRGC的树突场是共延的(Wong, 2007)。然而,这些组件在两个重要方面有很大的不同。 Firstly, whereas the intrinsic photoresponse is very sluggish, the extrinsic response is as rapid as the light responses of conventional RGCs (Figure 9) (Wong, 2007). The intrinsic response integrates photons over many seconds, while the extrinsic response enables ipRGCs to track rapid changes in light intensity (Wong, 2007; Do, 2009). Secondly, the intensity thresholds for rod input, cone input and melanopsin phototransduction are vastly different, roughly 7 log photons cm-2年代-1, 9log光子厘米-2年代-111log光子cm-2年代-1,分别(Dacey, 2005;赵,2014)。突触输入和固有光接收的不同动态范围使iprgc能够编码跨越至少9个数量级的光强度(Dacey, 2005)。
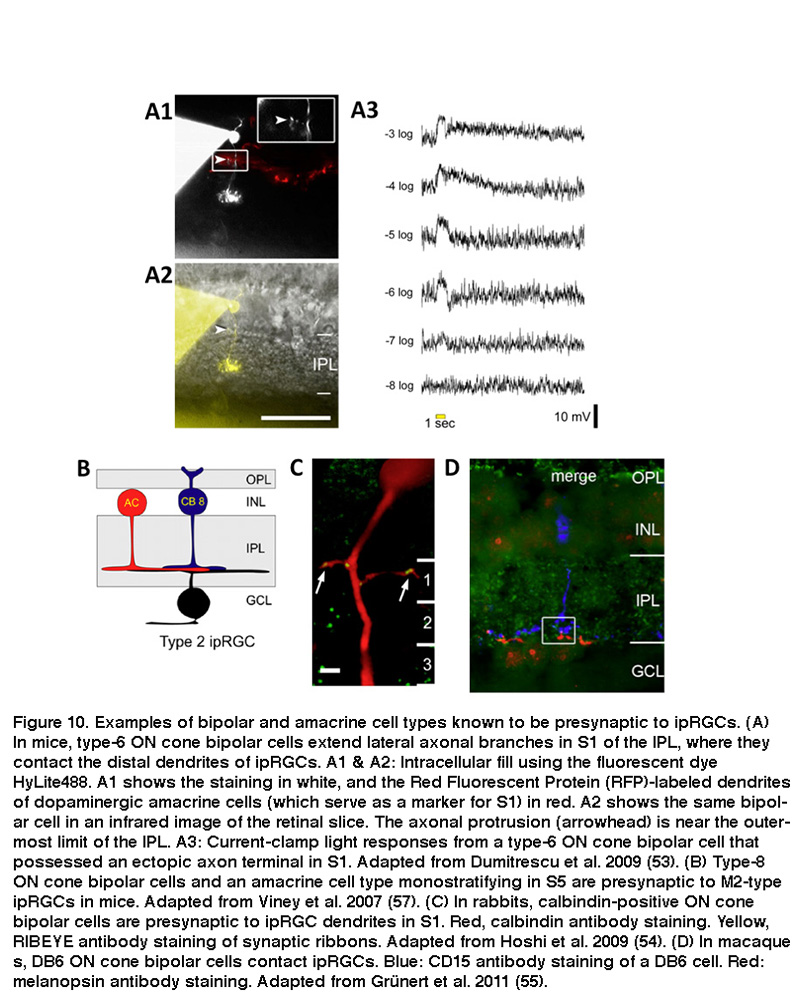
利用结合药理学的全细胞电压钳记录,研究人员证明了scn投射的iprgc在黑暗中有自发的抑制和兴奋性突触输入,并且它们表达谷氨酸、GABA和甘氨酸的受体(Perez-Leon, 2006;黄,2007)。光刺激增加了兴奋性谷氨酸能输入和抑制性氨基丁酸/甘氨酸能输入,这可能分别是由双极细胞和无分泌细胞介导的(Wong, 2007)。这两种输入主要引起ON光响应,尽管在某些条件下也可以看到相对较弱的OFF光响应(Wong, 2007;施密特,2010;赵,2014)。这种主要的ON通道输入是令人惊讶的,因为scn投射的iprgc的树突主要位于IPL的远端半部分,几十年来一直被认为是“OFF”亚小椎,在那里rgc只从OFF双极细胞而不是ON双极细胞接收输入(Nelson, 1978;费明力提1976)。ON双极细胞使用两种非常规的策略将谷氨酸释放到scn投射的小鼠ipRGCs的树突上。一些ON双极细胞的轴突向外侧延伸,其中包含突触囊泡(图10A),而另一些则包含突触囊泡顺道(顺便)轴突轴内的突触囊泡(Dumitrescu, 2009)。远端分层的iprgc也存在于兔子、绒猴和猕猴的视网膜中,它们同样在“OFF”小网膜中接受非常规的ON双极输入(图10C) (Hoshi, 2009;Grunert, 2011)。
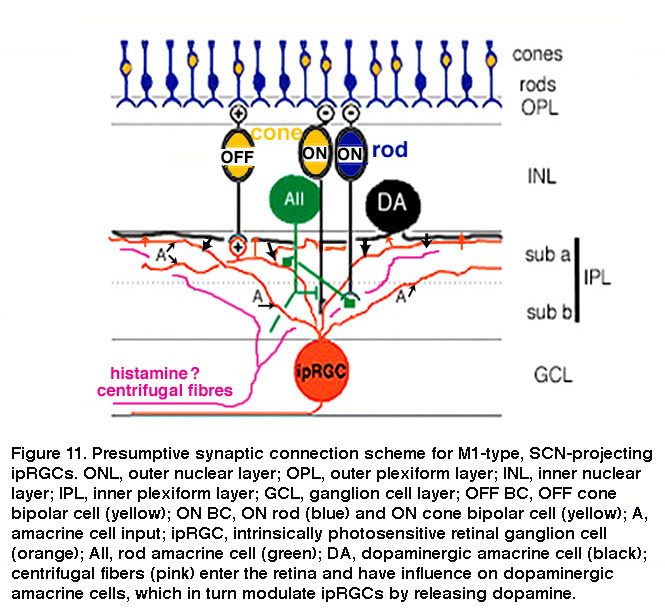
哺乳动物的视网膜包含大约12种类型的双极细胞和30多种类型的无分泌细胞(Kolb, 1981;Masland, 2011)参见网络视觉“无分泌细胞的作用”章节).在小鼠中,ON双极细胞使用轴突侧支接触“OFF”ipRGC亚节树突,表现为6型锥双极细胞(图10A) (Dumitrescu, 2009)。跨突触病毒追踪显示,这些“OFF”-亚层ipRGC树突也直接来自与这些ipRGC树突共层的多巴胺能无分泌细胞(Viney, 2007)。正如下面的“适应、神经调节和昼夜节律控制”中将详细讨论的那样,iprgc从多巴胺能无分泌细胞接受调节输入(Vugler, 2007;货车钩,2012)。跨突触病毒追踪还显示,近端分层的小鼠ipRGCs在“ON”亚板中有树突(见下面的“形态和生理多样性”)直接来自8型ON锥双极细胞和另一种单层无分泌细胞(图10B) (Viney, 2007)。在兔子和灵长类动物中,远端分化的iprgc分别与一种钙结合蛋白阳性的ON锥双极细胞(图10C) (Hoshi, 2009)和DB6 ON锥双极细胞(图10D) (Grunert, 2011)接触。除了直接接受ON锥双极输入外,ipRGCs也接受ON杆双极输入,尽管是多突触的,就像所有其他哺乳动物RGCs一样(Weng, 2013;Grunert, 2011)。具体来说,ipRGCs通过所有的无分泌细胞在ON锥体双极上形成间隙连接,然后在ipRGCs上突触。 Another putative pathway that affects ipRGCs may be added by centrifugal fibers entering the retina. These centrifugal fibers are known to be histaminergic (Gastinger, 1999) and they have an effect on dopaminergic amacrine cells in mouse retina through H1 receptors (Frazao, 2011). The synaptic input to “OFF”-stratifying ipRGCs is summarized in Figure 11.
6.Intraretinal突触输出
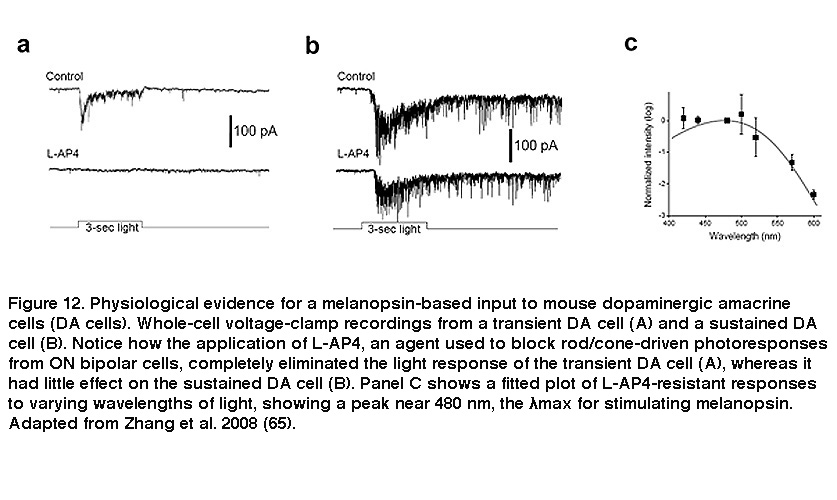
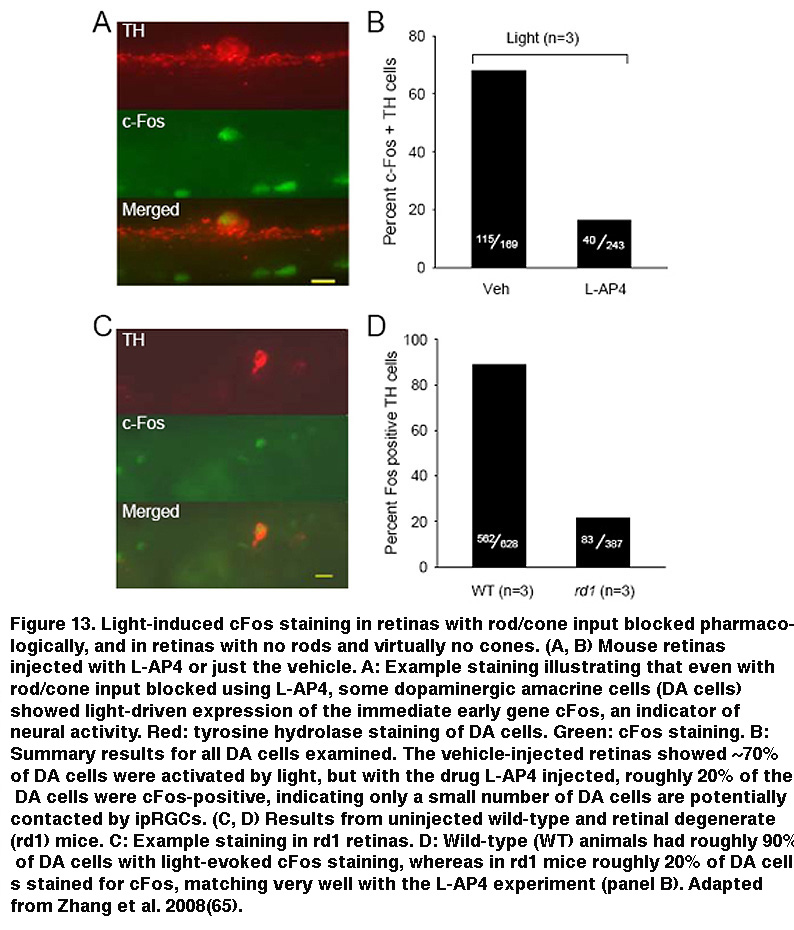
除了接受视网膜内突触输入外,ipRGCs还介导视网膜内突触输出。几十年来,rgc一直被认为是严格意义上的视网膜输出神经元,只向大脑的高级视觉中枢发出信号。但电子显微镜证据表明,在鲶的RGC树突是突触前的(Sakai, 1986), Douglas McMahon和合作者最近的研究证明,iprgc向多巴胺能无分泌细胞(DA细胞)的亚群发出信号。DA细胞释放的多巴胺扩散到整个视网膜,并根据当前的光照条件和一天中的时间重塑视网膜回路的功能特性,从而使视网膜成为一个更动态的系统(Dowling, 2012)。DA细胞有三种类型,对光表现出瞬时、持续和无响应(Zhang, 2007)。瞬时DA细胞的光响应被L-AP4消除,它阻断了对ON双极细胞的杆/锥信号(图12A)。相比之下,在L-AP4存在的情况下(图12B),或在杆状/锥体退化视网膜中(Zhang, 2008),持续的DA细胞保持对光反应。在L-AP4存在的情况下,DA细胞持续的光响应在接近480nm的波长达到峰值(图12C),与黑视素为基础的输入非常匹配(Zhang, 2008;张,2007)。在黑素敲除小鼠中,用L-AP4阻断ON双极输入消除了所有DA细胞的光反应,证实了抗L-AP4光反应源于ipRGCs (Zhang, 2012)。
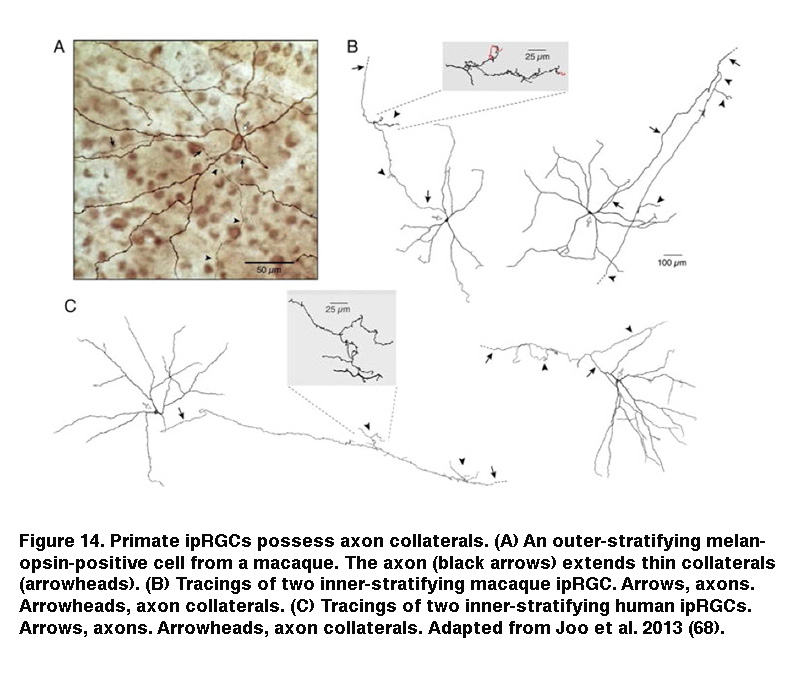
此外,对cFos(一种用于标记激活神经元的即时早期基因)的染色显示,在杆状/锥状退化视网膜中,持续光激活DA细胞的比例与注射了L-AP4的视网膜大致相同(图13)(Zhang, 2008)。敲除黑视素抑制光诱导的多巴胺释放(Dkhissi-Benyahya, 2013。这些观察结果强烈表明持续的DA细胞接受来自iprgc的输入。DA细胞和scn投射的ipRGC在IPL的最外层都有树突分层,这增加了这些ipRGC树突直接向DA树突发出信号的可能性(Vugler, 2007;维尼,2007)。观察到一些iprgc将轴突侧支向IPL延伸(图14)(Joo, 2013),也提示了另一种可能的传播途径。为支持后一种可能性,阻断电压门控钠+通道(存在于RGC轴突中),河豚毒素抑制ipRGC向DA细胞的信号传导(Prigge, 2016)。拮抗AMPA/kainate受体也干扰了ipRGC向DA细胞的输出(Zhang, 2012),提示ipRGC通过释放Na中的谷氨酸向DA细胞发出信号+spike-dependent方式。
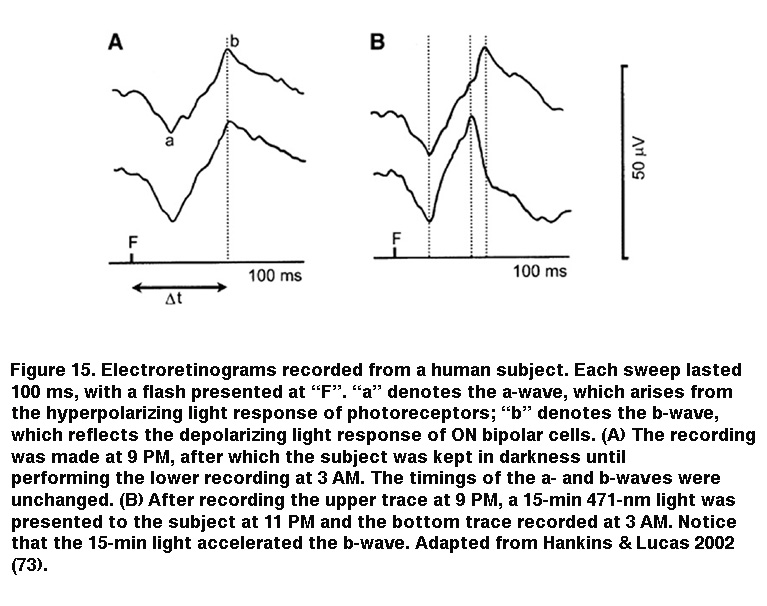
IpRGC向持续DA细胞发出信号可以解释严重杆/锥体变性大鼠视网膜中光诱导多巴胺分泌的原因(Morgan, 1980;Vugler, 2007)(但参见Cameron, 2009)。因为已知多巴胺在整个视网膜中发挥着无数的调节作用,iprgc向DA细胞的视网膜内输出可能影响图像形成的视网膜回路,一些研究加强了这种可能性。Mark Hankins和Rob Lucas使用一种称为视网膜电图的非侵入性场电位记录技术,发现长时间夜间光照改变了人体实验对象ON双极细胞的光响应动力学(图15)。这种效应表现出了非常长的整合时间,在483 nm光下诱导效果最佳,暗示了一种基于黑素的机制(Hankins, 2002)。同样的研究人员随后观察到老鼠视网膜电图的振幅和动力学的昼夜节律,在敲除黑视素后,这些节律就消失了(Barnard, 2006)。ipRGC调节视网膜功能的其他证据来自于Ouria Dkhissi-Benyahya等人的一项研究,该研究检测了视杆和视锥细胞中的时钟基因表达。在野生型小鼠中,这些时钟基因(被认为驱动视网膜内的昼夜节律)的表达呈现每日节律,但当黑视素被清除时,这种节律就会被大幅抑制(Dkhissi-Benyahya, 2013)。
Ca2 +影像学提示ipRGCs视网膜内信号的另一个潜在途径。在正常生理条件下,无杆圆锥小鼠视网膜约3%的神经节细胞层(GCL)细胞钙含量增加2 +但在缝隙连接阻滞剂卡苯酮的存在下,这一比例下降到约1%,这导致作者提出ipRGCs通过缝隙连接将它们的光响应传播到GCL中的无分泌细胞(“移位的无分泌细胞”)(Sekaran, 2003)。但这一结论受到了后续研究的挑战,研究表明卡苯氧酮具有多种非特异性作用,并可消除光驱动下钙的增加2 +信号甚至在机械分离的iprgc中(Bramley, 2011)。尽管如此,已经观察到ipRGCs和移位的无分泌蛋白之间的示踪染料耦合(Muller, 2010),因此ipRGCs通过缝隙连接介导的视网膜内信号传递仍然是一种可能。最近的一项研究表明,大鼠ipRGCs确实将其基于黑视素的光反应传递给移位的无分泌细胞(Reifler, 2015)。我们对2000个随机靶向移位的无分泌细胞进行了全细胞记录,以寻找表现出峰值的、持续的ON光反应的细胞,发现了154个这样的细胞。令人惊讶的是,在L-AP4、DNQX和D-AP5浸泡过程中,它们仍然光敏,完全阻断了向视网膜内的杆/锥信号。在这些药物存在的情况下,所有154个无极性毛锥的去偏光响应与ipRGCs的固有光响应相似,但在加入间隙结阻滞剂甲氯胺酸后,它们失去了所有的光敏性,这表明ipRGCs通过间隙结向这些无极性毛锥发出信号(Reifler, 2015)。
7.形态和生理多样性
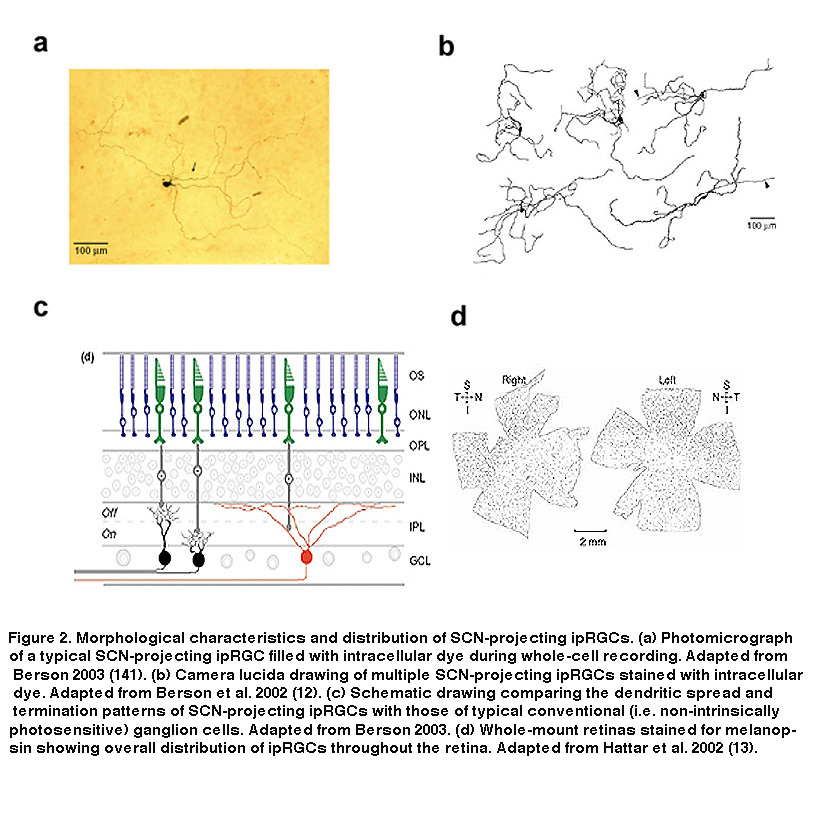
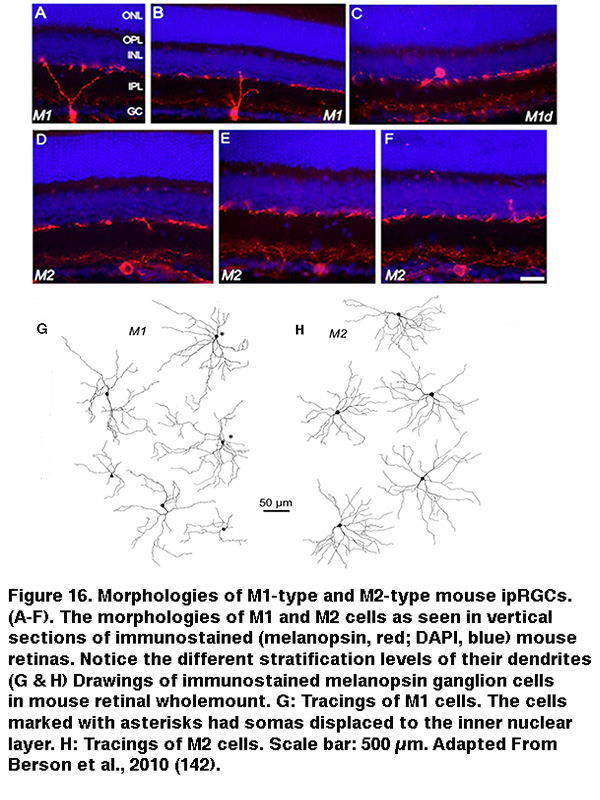
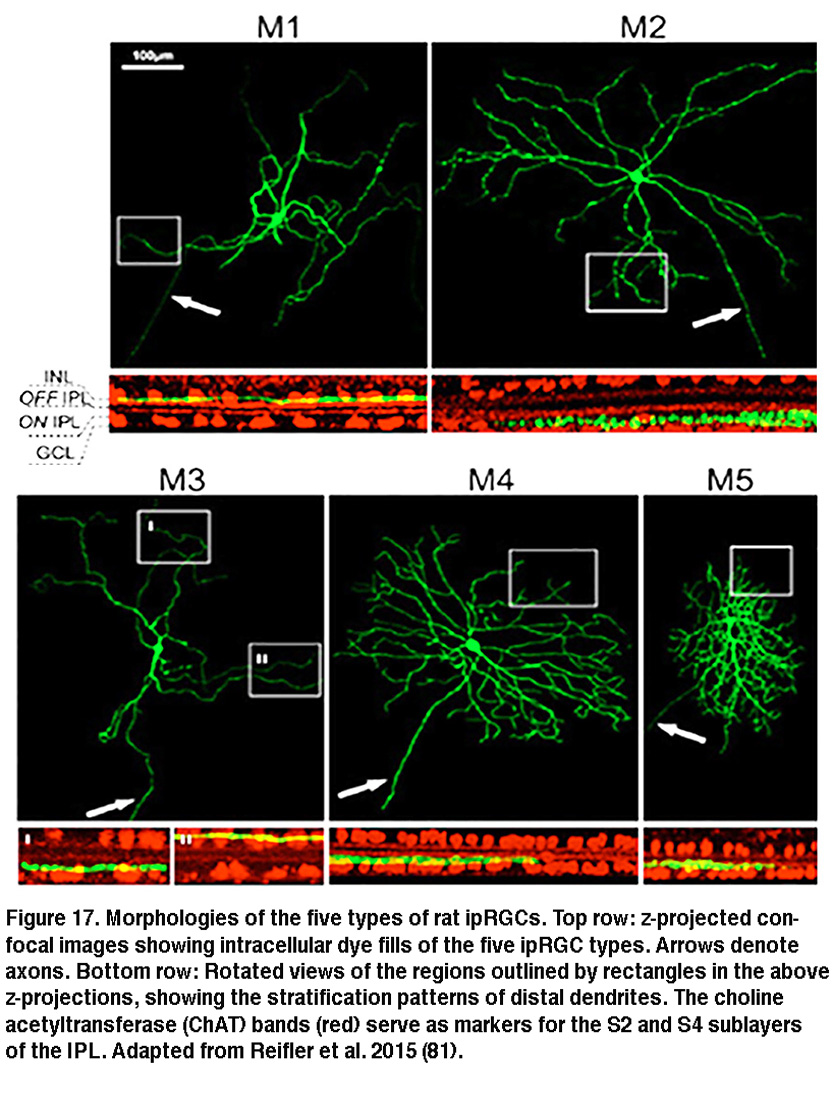
投射scn的大鼠和小鼠的iprgc在形态学上似乎是同质的,这表明它们构成了单一的细胞类型(但见(Baver, 2008))。所有这些细胞在GCL神经元中有中等大小的体细胞,并在IPL最外层的亚层(“S1”)末端有稀疏的树突,与黑素免疫反应树突的主丛相对应(图16A-C, G) (Berson, 2002;汉尼拔,2002;Hattar, 2002)。然而,21世纪初的一些研究表明存在多种类型的iprgc。例如,在IPL的最内层(“S5”)还有一个黑视素阳性树突丛(Provencio, 2002)。Ca2 +成像和“盲”多电极阵列细胞外尖刺记录也显示了在GCL中不同的黑素介导的光反应(Sekaran, 2003;你,2005)。通过使用各种荧光标记技术,后续工作揭示了在小鼠视网膜中至少存在五种形态类型的表达黑素的ipRGCs。最初由David Berson描述的scn投影类型现在被称为“M1”,而新的类型被称为M2, M3, M4和M5 (Viney, 2007;施密特,2008;埃克,2010)。小鼠M2细胞的例子见图16D-F, h。通过从随机选择的大样本RGCs的全细胞记录,在大鼠中也发现了ipRGCs的所有五种形态类型(Reifler, 2015);代表性的例子如图17所示。在这些ipRGC类型中,M1是唯一专门分层于IPL的S1中的ipRGC类型。M3是唯一的双层类型,树突向S1和S5延伸。 The remaining ipRGC types are all monostratified in S5, with M2 having relatively sparse dendrites, M4 having denser and radiate dendrites similar to the previously described alpha cell (Estevez, 2012; Schmidt, 2014), and M5 having the densest dendrites covering the smallest fields (Figure 17).
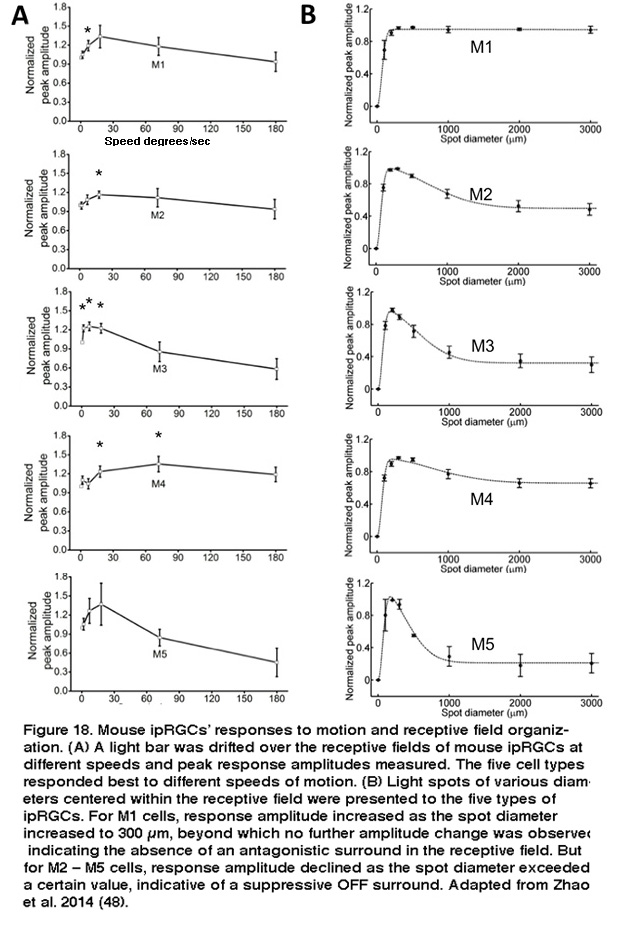
这五种类型的iprgc表现出不同的生理特性,表明它们具有不同的功能。在小鼠和大鼠中,五种ipRGC类型以不同的频率自发增加(Reifler, 2015;赵,2014)。不同类型的小鼠ipRGCs在膜电阻、膜电容、Na等基本生物物理特性上也存在显著差异+波形,Na+峰值阈值和电压门控Ca2 +和K+电流(施密特,2009;胡,2013)。在适应黑暗的条件下,五种小鼠ipRGC类型对全场光的反应相当相似,产生持续的去极化反应,并持续光的持续时间(Zhao, 2014)。然而,在光适应条件下,M1和M2的锥驱动全场光响应明显不同,前者的响应要短暂得多,振幅也低得多(Schmidt, 2010)。在不同类型的细胞对移动的光和不同大小的光点的反应上也观察到了多样性,即使在适应黑暗的条件下也是如此。这五种细胞对移动光的反应比静止光更强烈;然而,不同的细胞类型似乎适应不同的运动速度(图18A)。
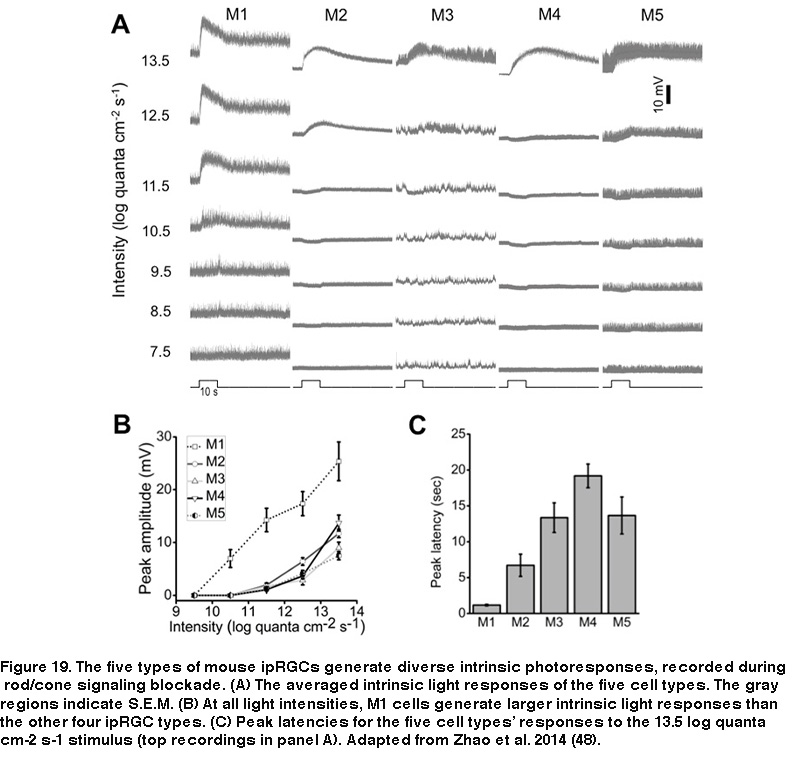
此外,尽管M1的感受野只包含一个ON-center区域,但非M1 iprcs的感受野显示ON-center/OFF-surround拮抗作用,因此照亮整个感受野的大光斑比仅覆盖中心区域的小光斑诱导的反应更弱(图18B) (Zhao, 2014)。在阻断杆/锥信号的条件下,大鼠和小鼠的五种ipRGCs会产生基于黑素的光反应,这些反应在动力学、振幅和阈值上有所不同,其中M1细胞的固有光反应最快、最大、最敏感(图19)(Reifler, 2015;赵,2014;埃克,2010;施密特,2009;这几年会,2012)。
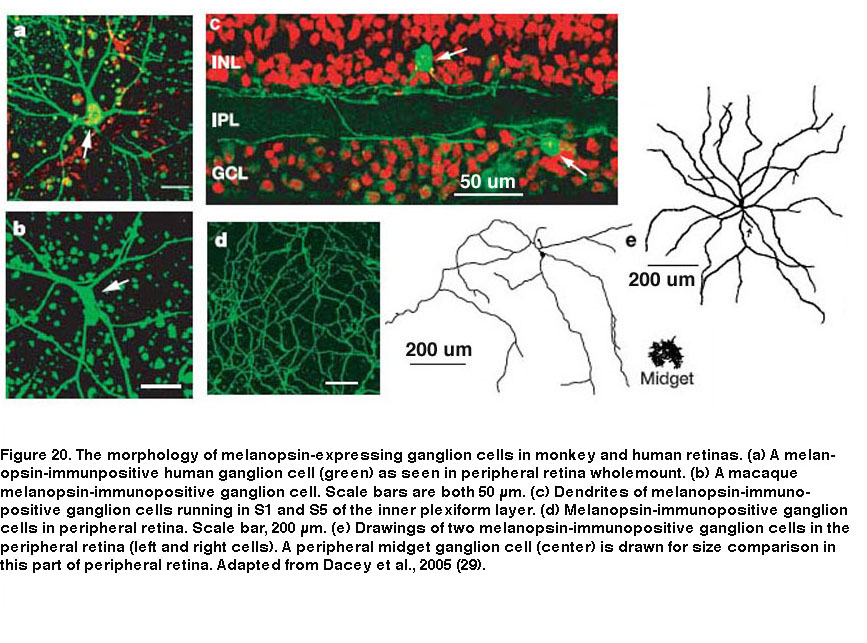
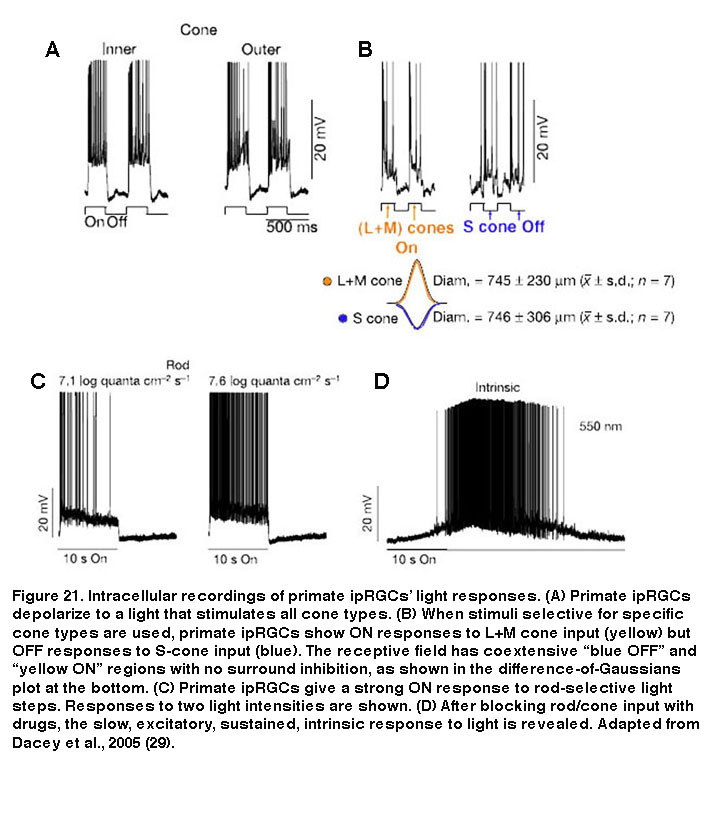
除了小鼠和大鼠之外,许多其他被研究的物种也具有多种形态和/或生理类型的ipRGC,尽管尚不清楚这些其他物种是否也具有五种ipRGC类型。在包括人类在内的灵长类动物中,只有两种形态的表达黑视素的rgc被记录在案(图20)。这两种细胞类型都有巨大的体细胞和稀疏的单层树突。外分层型在S1中分层,而内分层型在S5中分层,因此它们可能与啮齿类动物中发现的M1和M2型同源(Dacey, 2005;名,2007;Grunert, 2011;汉尼拔,2014;诺依曼,2011)。外分层细胞的树突场在视网膜上几乎没有重叠,但它们与内分层细胞的树突场有很大重叠,这表明它们构成了两种不同的细胞类型(Jusuf, 2007)。灵长类动物的外层和内层ipRGCs的感受野仅由一个on中心区域组成,两种细胞类型似乎都产生了非常相似的杆驱动、锥驱动和黑素介导的光反应(图21)(Dacey, 2005)。 Moreover, both types project to the lateral geniculate nucleus and olivary pretectal nucleus (see “Central Projections” below for further information) (Dacey, 2005; Dacey, 2003). Thus, functional differences between the outer- and inner-stratifying primate ipRGCs remain elusive, although there is anatomical evidence that they receive different synaptic inputs (Jusuf, 2007; Neumann, 2011).
8.中央的预测
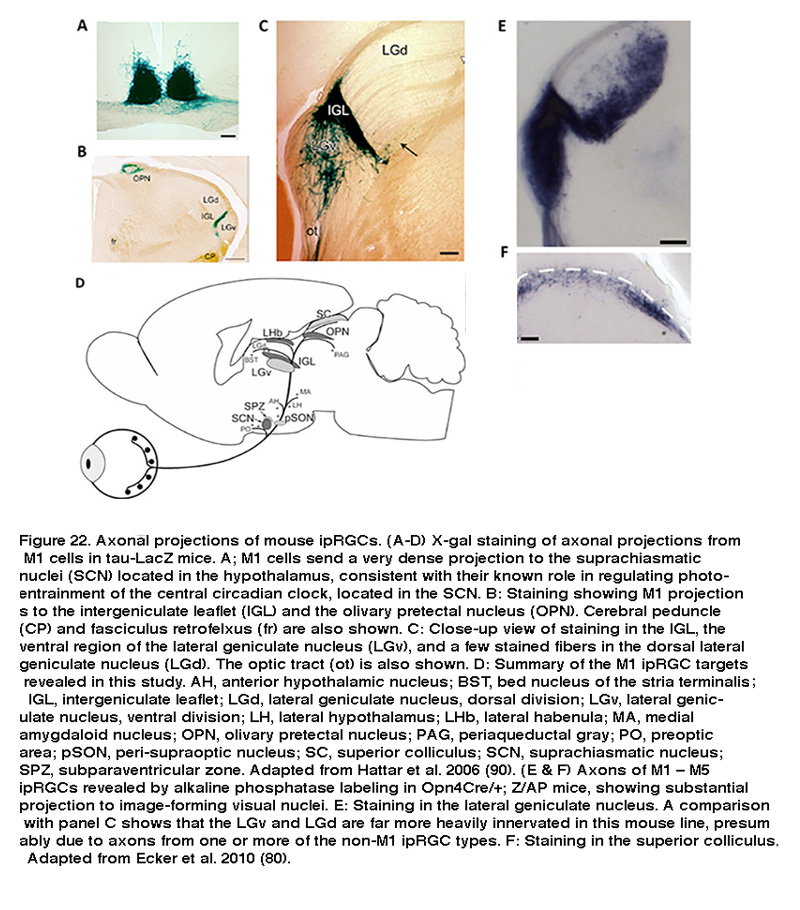
Samer Hattar等人利用ipRGCs表达标记酶β-半乳糖苷酶的转基因小鼠系,可视化了m1型ipRGCs的轴突,并描述了它们在整个大脑中的投射。正如预期的那样,Hattar和他的同事发现m1型iprgc向SCN、髌间叶(IGL)和橄榄状顶盖前核(OPN)发送密集投影(图22A-C) (Hattar, 2006)。SCN和IGL是昼夜节律系统的一部分,而OPN调节瞳孔光反射。除了这些预期的地点,同样的研究还发现了一些其他的中心目标。在下丘脑中,M1细胞将轴索纤维发送到室旁下区腹侧,这是一个控制自主神经系统的区域。在视交叉核的外侧,一些分散的纤维到达视前区外侧和腹外侧区,从而影响垂体生殖激素的释放(Hattar, 2006年)。本研究中确定的大脑靶点如图22D所示。这些中心投影表明M1细胞调节一系列不同的非图像形成视觉功能。
最近,他们使用一种更加敏感的基于cres的黑视素报告鼠系来标记所有五种ipRGC类型,Hattar和同事们检测到明显的ipRGC投射到另外两个视觉核:外侧膝状核(LGN)和上丘(SC)的背侧区,前者是视网膜输入到视觉皮层的主要丘脑中继点,后者是一个感觉运动核,可以检测新的视觉刺激(图22E, F)。逆行和顺行标记表明,灵长类动物的iprgc也投射到LGN和SC (Dacey, 2005;汉尼拔,2014)。这些发现表明,除了众所周知的调节潜意识视觉反射的作用外,ipRGC可能有助于有意识的视觉感知,这一可能性得到了电生理学和行为学研究的大力支持(见下文“ipRGC功能的行为方面”)。
9.适应,神经调节和昼夜节律控制
IpRGC光敏性表现出各种形式的可塑性。黑视蛋白光转导的增益受背景光水平和光照历史的影响。IpRGCs的光反应也由视网膜内释放的神经调质调节。此外,这些神经元的光响应振幅取决于一天中的时间,这表明它受到昼夜节律的控制。本节将考虑ipRGC可塑性的所有三个方面。
图像形成视觉系统可以在环境光强度的广beplay体育公司谱范围内工作,覆盖超过十个数量级。虽然这个范围很大程度上是由于存在两个独立的光感受器系统(视杆细胞和视锥细胞),它们在不同的光强范围内工作,但部分能力是由于视杆细胞和视锥细胞都有能力改变它们对光的敏感性,这个过程被称为适应(Perlman, 1998)。当有恒定的背景光时,杆和锥产生初始峰值响应,在稳定的照明下放松,表明随着时间的推移对光的脱敏。这种脱敏使光感受器增加了它们的动态范围,因此它们可以对原本饱和的光强度作出反应。这被称为“光适应”。相反,当回到黑暗环境中时,视杆细胞和视锥细胞会逐渐恢复它们的敏感性,这个过程被称为“黑暗适应”。光和暗的适应都是光转导级联变化的直接结果。杆状细胞适应背景照明的能力相对有限,在高亮度下饱和,而锥状细胞表现出几乎无限的适应亮度的能力(Fain, 2001;诺克斯,2006)。
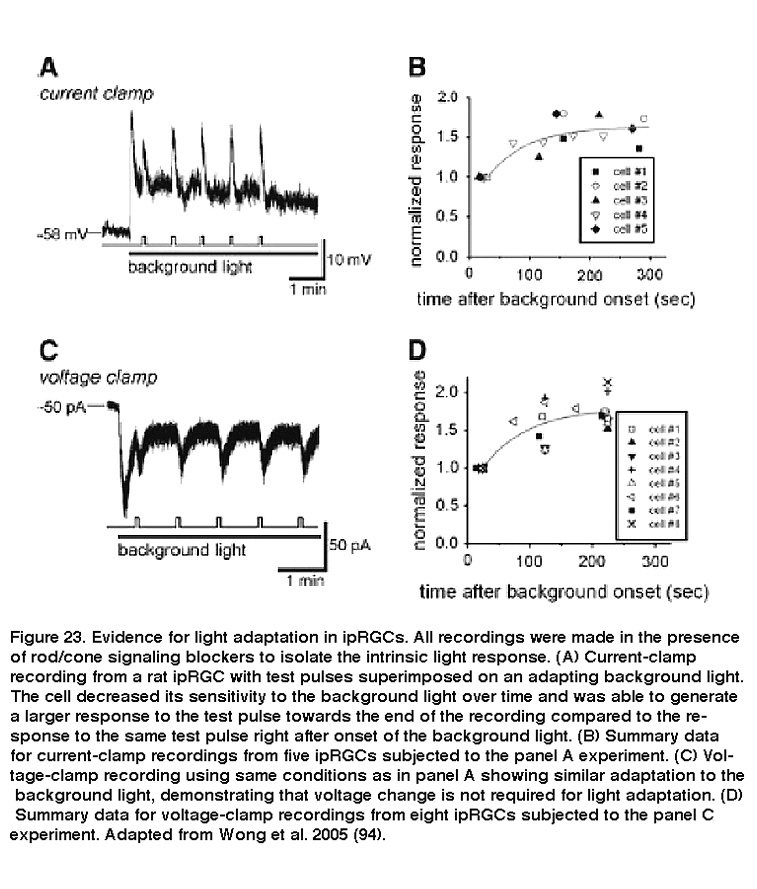
由于它们在绝对光水平的稳定表示中所起的作用,以及它们不同寻常的强韧响应特性,最初并不清楚ipRGCs的固有光敏性是否会显示出类似杆状和锥体的适应机制。David Berson及其同事发现,当iprgc暴露在接近饱和的背景光下时,这些细胞逐渐变得脱敏,而随着时间的推移,对背景光顶部较亮的光脉冲的反应会变大(图23)。
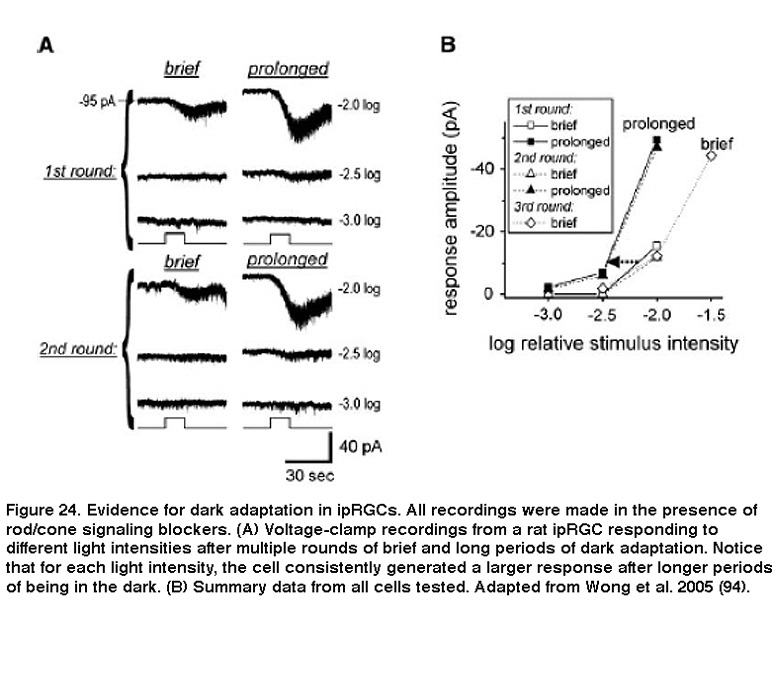
背景光也加速了光响应动力学,因此对光脉冲的响应达到峰值更快,在脉冲停止后也更快地衰减到基线。这些都是光适应的标志。此外,当先前适应光的iprgc被置于黑暗中时间延长时,它们对相同光刺激强度的反应增强,这明显表明它们适应了黑暗(图24)(Wong, 2005)。虽然黄et al。2005年(Wong, 2005)发现ipRGC对光和暗的适应比经典的光感受器慢得多,后续的工作揭示了ipRGC和棒/锥适应之间的两个重要相似之处:对所有三种光感受器类别,闪光灵敏度vs。背景强度之间的关系可以用韦伯-费希纳定律描述,光适应至少部分受Ca的调节2 +(做什么,2013)。考虑到iprgc使用的光转导级联与杆状细胞和锥状细胞截然不同(见上面的“光转导”部分),这些相似之处多少有些令人惊讶。
除了上述对ipRGCs固有光敏性的急性适应作用外,长时间暴露在光或黑暗中显著调节黑视素mRNA水平。在持续黑暗的大鼠中,黑视素的表达持续上升至少5天,而在持续光照的大鼠中,黑视素mRNA在7天后几乎完全消失(Hannibal, 2005)。
正如前面在“视网膜内突触输出”一节中提到的,多巴胺是一种重要的神经调节剂,对视网膜功能有广泛的影响。因此,毫不奇怪,它已经被证明可以调节iprgc。研究发现,多巴胺和d1类多巴胺受体激动剂可急剧减弱分离的iprgc的内在光反应(Van Hook, 2012)。此外,d2类多巴胺激动剂的长期应用提高了黑视素和垂体腺苷酸环化酶激活肽(PACAP)的mRNA水平,PACAP是ipRGCs中存在的一种肽(Sakamoto, 2005)。据报道,腺苷在夜间和长时间的黑暗中似乎会上升(Ribelayga, 2005),它会缩短ipRGCs内在光反应的持续时间,但与多巴胺不同,它不会显著降低这些反应的峰值振幅(Sodhi, 2014)。褪黑素也主要在夜间释放,有报道称它可以调节m4型大鼠ipRGCs的杆/锥驱动光反应(Pack, 2015)。最后,有间接证据表明无分泌细胞释放的胆囊收缩素调节视网膜对中央昼夜节律钟的输入(Shimazoe, 2008)。
众所周知,ipRGC调节中央昼夜节律时钟的光夹带(见下文“ipRGC功能的行为方面”)。但有证据表明,这些rgc本身也受昼夜节律的调节。在光/暗(“LD”)和恒暗(“DD”)条件下,大鼠视网膜中的黑视素mRNA水平显示出每日节律。这种节律在杆状/锥体退化大鼠中消失,这表明它是由视网膜昼夜节律时钟而不是SCN的中央昼夜节律时钟驱动的{Sakamoto, 2004 #138}。多电极阵列细胞外记录确实表明,与所有其他被检测的昼夜节律时间相比,大鼠ipRGCs在主观夜晚早期固有光反应的振幅在统计上有显著增加(Weng, 2009),尽管这种增加比黑视蛋白mRNA表达昼夜节律的振幅小得多(Sakamoto, 2004)。M4 ipRGCs的突触驱动光响应也表现出昼夜变化(Pack, 2015)。
10.ipRGC功能的行为方面
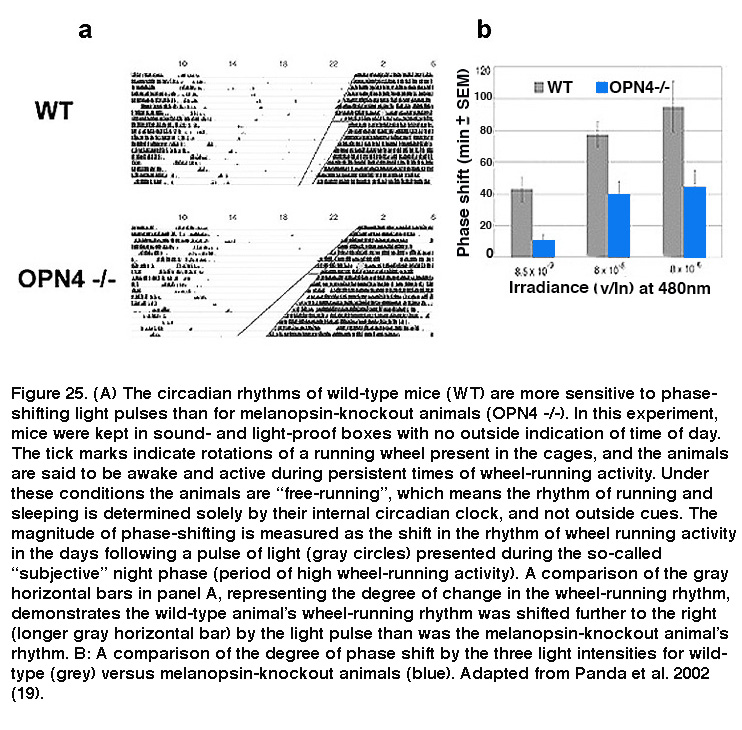
哺乳动物生理和行为的日常节律,统称为昼夜节律,是由下丘脑SCN中的一小簇细胞控制的。SCN神经元具有转录/翻译为基础的分子时钟,使它们能够自主调节接近24小时节律的活动模式,这最终导致每天的行为变化,如睡眠/觉醒周期和核心体温节律。然而,昼夜节律时钟并不能完美地调整到24小时,为了适应动物环境中明暗相位的变化,SCN必须定期重置,以使昼夜节律与明暗周期同步(或“夹带”)。光是迄今为止最有效的昼夜诱捕线索,ipRGCs是携带这一信号的主要细胞,因为在小鼠中消除了这些神经元就取消了光诱捕(Hatori, 2008;沙丘状积砂,2008;居尔,2008)。敲除黑素的动物有相对正常的昼夜节律,在吸收光线的能力上没有表现出任何明显的功能障碍。然而,光脉冲在这些动物的昼夜节律中诱导的相位变化明显更小(图25),揭示了黑视素信号传递的关键作用(Panda, 2002;Ruby, 2002)。另一方面,光棒对于光线夹带昏暗是必不可少的(Altimus, 2010; Lall, 2010), whereas cones are important for proper responses of the photoentrainment system to short-duration light pulses (Dkhissi-Benyahya, 2007; Dollet, 2010).
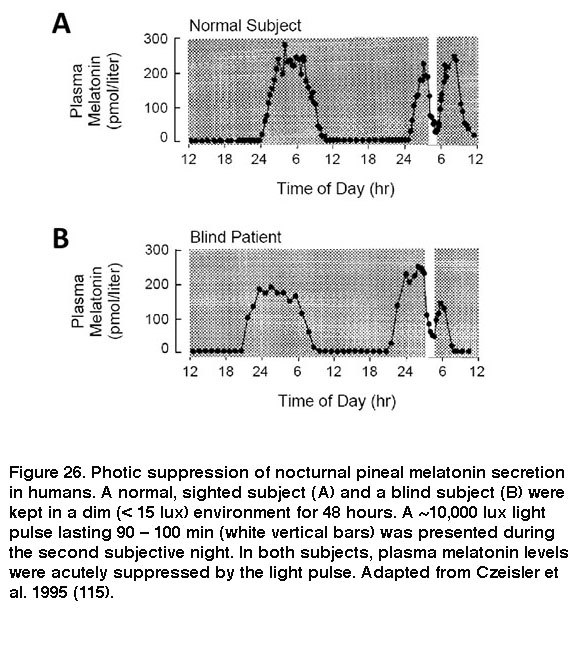
SCN通过各种神经回路发出信号,协调全身的昼夜节律。在其中一个回路中,SCN调节松果体向血液中分泌促进睡眠的褪黑激素:SCN >下丘脑室旁核>脊髓中间外侧核>颈上神经节à松果体(Larsen, 1998)。由于这种SCN调节,褪黑激素只在主观性夜间从松果体释放。然而,当暴露在足够强的光下时,ipRGC的输入会严重抑制褪黑激素的释放(Brainard, 2001;Thapan, 2001;Vartanian, 2015)。由于ipRGCs在没有视杆和视锥的情况下仍然光敏,无视杆小鼠和一些盲人患者继续表现出这种非图像形成的视觉反应(图26)(Lucas, 1999;泽斯,1995;扎伊迪,2007)。
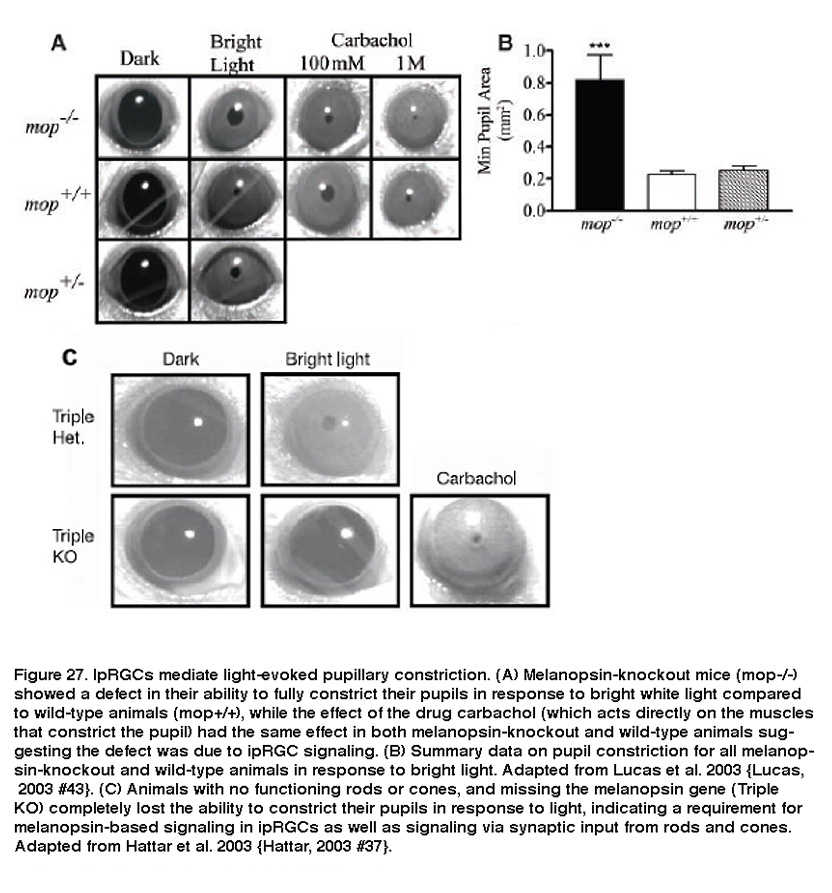
IpRGCs还负责光引起的瞳孔收缩。ipRGC轴突投射到OPN(负责瞳孔光反射的视网膜受体部位),使它们可能成为调节这种反应的候选者。事实上,黑素敲除动物在高辐照水平下瞳孔光反射减弱(图27A, B) (Lucas, 2003)。此外,没有功能杆或锥体的黑视素敲除小鼠完全无法在对光的反应中收缩瞳孔(图27C) (Hattar, 2003;熊猫,2003)。此外,使用各种方法杀死iprgc会显著减弱瞳孔光反射(Guler, 2008;Hatori, 2008)。
据报道,许多其他非成像光反应至少部分是由iprgc介导的。这些包括小鼠夜间运动活动的急性抑制(“负性遮蔽”)(Mrosovsky, 2003),睡眠的光诱导(“光性睡眠”)(Lupi, 2008;莫林,2011;Altimus, 2008;Tsai, 2009)和维持小鼠的光诱导睡眠(Muindi, 2013),调节人类的认知表现(Vandewalle, 2007;Vandewalle, 2013),增强人类的警惕性(Viola, 2008),大鼠(Iyilikci, 2009)和人类(Meesters, 2011)的抗抑郁作用,人类的光诱导头痛加剧(Noseda, 2010),小鼠的畏光和避光(Johnson, 2010;Matynia, 2012)、光依赖性血管松弛(Sikka, 2014)和刺激女性卵泡刺激素(FSH)的分泌(Danilenko, 2015)。
此外,有新的证据表明,黑视素有助于视觉感知,这可能是由ipRGC投射到LGN和/或SC介导的(Dacey, 2005;布朗,2010;埃克,2010;这几年会,2012;赵,2014)。一些患有严重视网膜外变性但相对正常的ipRGCs具有基本的检测强蓝光存在的能力(Zaidi, 2007),而视力完全的人和小鼠似乎在一定程度上依赖黑视素进行亮度识别(Brown, 2012)。缺乏杆状/锥状光接收功能(但黑视蛋白光接收功能完整)的小鼠能够区分显示黑白条纹的计算机屏幕和平均强度相同的均匀灰色屏幕,这表明黑视蛋白足以实现一定程度的模式视觉(Ecker, 2010)。也有初步的心理物理学证据表明,黑视素直接影响人类的色觉,挑战了三色理论(Horiguchi, 2013)。最近,研究显示缺乏黑视素的小鼠在对比敏感度方面存在行为缺陷(Schmidt, 2014)。
iprgc很可能执行额外的图像形成视觉功能,因为在保留突触输入的条件下,灵长类动物的iprgc从视锥细胞接收颜色对照(蓝色OFF,黄色ON)输入(图21B),暗示了一种颜色辨别能力(Dacey, 2005)。此外,除M1细胞外,其他四种类型的小鼠iprgc都具有拮抗ON-center、OFF-surround区域的感受野(图18B),表明这些细胞具有空间分析功能(Estevez, 2012;赵,2014)。最后,五种类型的鼠标iprgc被调整到不同的运动速度(图18A),提高了它们有助于运动分析的可能性(Zhao, 2014)。
11.角色的发展
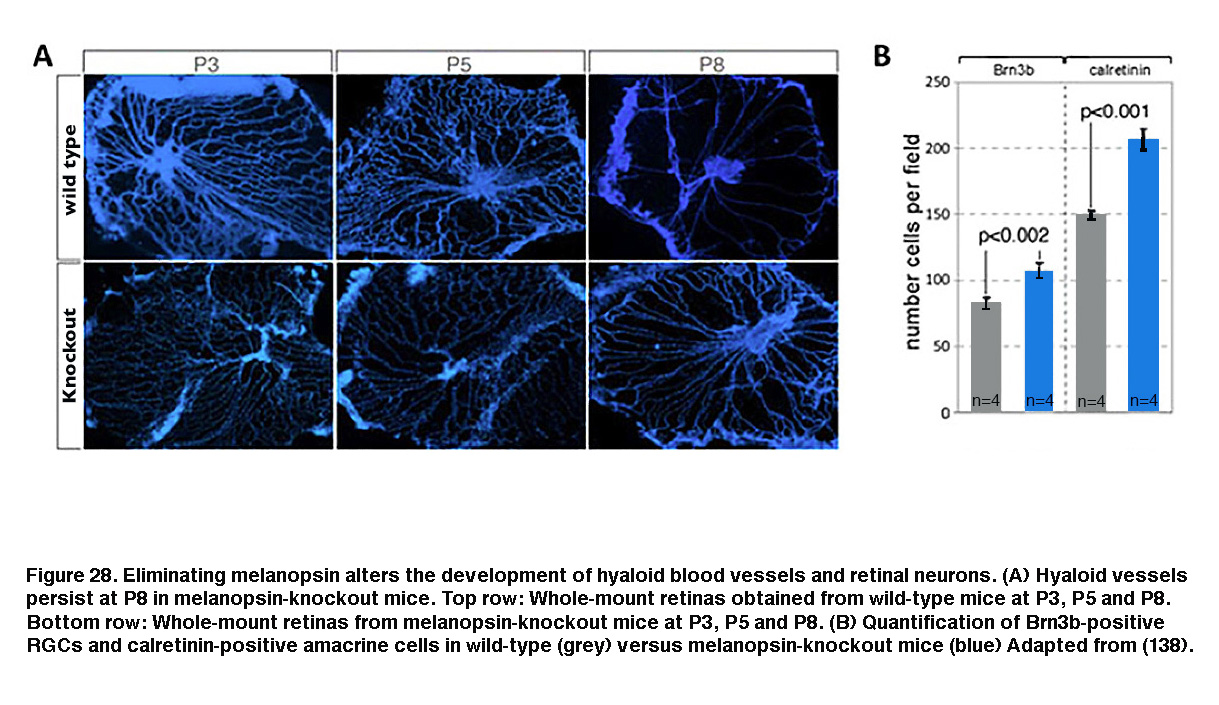
黑视素的表达在出生前就开始了(Tarttelin, 2003), iprgc比杆状细胞或锥状细胞更早感光(Sekaran, 2005;你,2005)。这种以黑视素为基础的光敏性的早期出现的一个功能是负趋光性,这导致幼鼠在P6(出生后第6天)时远离强光(Johnson, 2010)。黑视素也被证明调节视网膜神经元、视网膜血管和视网膜膝状回路的早期发育。在正常光/暗条件下饲养的野生型小鼠,胚胎透明质脉管系统退化,视网膜脉管系统在出生后早期开始形成。但在黑视素敲除小鼠或妊娠后期深色饲养的小鼠中,透明体血管的退化被推迟,视网膜血管过度生长(图28A,下排)。此外,rgc和无分泌细胞的数量增加(图28B,蓝色)。这些观察结果表明,在妊娠后期,黑素介导的光检测激活了抑制GCL神经元数量的信号通路,并调节了血管发育的时间(Rao, 2013)。
正如上文“视网膜内突触输出”部分所述,ipRGCs不仅向大脑发出信号,还向视网膜内部发出信号。iprgc的视网膜内信号在P4上已经很明显。除了参与离子调节(Berkowitz, 2010),这种早期信号还控制视网膜波的时间特性。视网膜波是动作电位的自发爆发,在出生后发育早期通过RGCs传播,它们有助于视网膜膝状投影的细化。在野生型小鼠中,光增加了每次脉冲爆发的持续时间,来自同侧和对侧视网膜的传入轴突终止于LGN背侧的不同部分。然而,在黑素敲除小鼠中,这种光对爆发持续时间的影响是不存在的,同侧和对侧视网膜输入到背侧LGN的分离变得更少(Renna, 2011。
12.结论
IpRGCs是哺乳动物的光感受器,其形态和生理特征似乎非常适合其作为非图像形成视觉反射的光探测器的主要作用。由于它们是最近才被发现的,所以仍有许多谜团存在,这种罕见而特殊的神经节细胞的无数功能不应被忽视。它们类似无脊椎动物的光转导级联使它们在已知的脊椎动物光感受器中独一无二,并为研究视网膜进化的可能机制提供了一扇窗。除了固有的黑视素驱动的光敏感度外,ipRGCs还接受杆状和锥状突触的输入,因此可能会为大脑提供一系列不同的信息,这些信息被复杂的空间和时间动态分开。尽管它们驱动了一些强直行为,需要长时间准确表示环境光水平,但iprgc可以适应光明和黑暗。它们有能力与视网膜进行通信,这可能会改变视网膜成像回路的功能特性。新出现的证据表明,iprgc也可以直接促进有意识的视觉感知。最后,这些RGCs调节视网膜的早期发育和视网膜膝缩通路。随着这一相对年轻的神经节细胞光感受器领域的发展,许多RGC类型开始看起来是光感受器,并发挥不同的功能作用。
参考文献
Acharya JK, Jalink K.等。InsP3受体对果蝇的生长和分化是必需的,但对视力不是。神经元。1997;18(6):881 - 7。[PubMed]
Altimus CM, Guler AD, Alam NM, Arman AC, Prusky GT, Sampath AP和Hattar s。杆状光感受器驱动昼夜光夹带穿越广泛的光强度。神经科学杂志13:1107-1112,2010。[PubMed]
Altimus CM, Guler AD, Villa KL, McNeill DS, Legates TA和Hattar s。视锥细胞和黑视素检测光和暗来调节睡眠,独立于图像形成。美国国家科学院学报第105期:19998- 2003,2008。[PubMed]
眼睛和感光细胞类型的进化。中国生物医学工程杂志,2003;29(3):369 - 369。[PubMed]
巴洛HB,莱维克WR。限制猫视网膜神经节细胞对光的可靠检测的三个因素。杂志。1969;200(1):24。[PubMed]
巴纳德AR,哈特S,汉金斯MW和卢卡斯RJ。黑视素调节小鼠视网膜的视觉处理。生物学报16:389-395,2006。[PubMed]
Baver SB, Pickard GE, Sollars PJ和Pickard GE。两种黑视素视网膜神经节细胞分别支配下丘脑视交叉上核和橄榄状顶盖前核。神经科学杂志27:1 - 7,2008。[PubMed]
Belenky MA, Smeraski CA.等。黑视素视网膜神经节细胞接受双极和无分泌细胞突触。中华神经科学杂志2003;46(3):380-93。[PubMed]
Berkowitz BA, Roberts R和Bissig D.用锰增强MRI评估年轻清醒和自由运动小鼠中黑视素对视网膜内离子的光依赖性调节。分子生物学与分子生物学,2010。[PubMed]
Berson DM, Dunn FA。et al。视网膜神经节细胞的光转导设定昼夜节律时钟。科学。2002;295(5557):1070 - 3。[PubMed]
神经节细胞光感受器的光转导。弗鲁格拱门。2007;454(5):849 - 55。[PubMed]
Berson, DM, Castrucci AM和Provencio I(2010)小鼠视网膜神经节细胞表达黑视素的形态和镶嵌。神经杂志518,2405-2522。[PubMed]
Brainard GC, Hanifin JP, Greeson JM, Byrne B, Glickman G, Gerner E和Rollag MD。人类褪黑激素调节的作用谱:一种新的昼夜光感受器的证据。中华神经科学杂志21:644 - 644,2001。[PubMed]
Bramley JR, Wiles EM, Sollars PJ和Pickard GE。在孤立的黑视蛋白神经节细胞光感受器中,卡苯酮阻断了光诱发的细胞内钙的上升。PLoS One 6: e22721, 2011。[PubMed]
Brown TM, Gias C, Hatori M, Keding SR, Semo M, Coffey PJ, Gigg J, Piggins HD, Panda S和Lucas RJ。黑视素对丘脑-皮质视觉系统的辐照度编码有贡献。beplay体育公司生物学报8:e1000558, 2010。[PubMed]
Brown TM, Tsujimura S, Allen AE, Wynne J, Bedford R, Vickery G, Vugler A, Lucas RJ。小鼠和人类基于黑素的亮度辨别。中华生物学报22:1134-1141,2012。[PubMed]
Cameron MA, Pozdeyev N, Vugler AA, Cooper H, Iuvone PM和Lucas RJ。视网膜多巴胺的光调节与黑视蛋白光转导无关。中华神经科学杂志29:761-767,2009。[PubMed]
Chew KS, Schmidt TM, Rupp AC, Kofuji P和Trimarchi JM。gq/11基因的缺失并不能消除黑视素的光转导作用。公共科学图书馆9:e98356, 2014。[PubMed]
徐志强,王晓东,王晓东,等。多不饱和脂肪酸激活果蝇光敏通道TRP和TRPL。大自然。1999;397(6716):255 - 9。[PubMed]
Czeisler CA, Shanahan TL, Klerman EB, Martens H, Brotman DJ, Emens JS, Klein T,和Rizzo JF,第三。暴露在强光下对一些盲人患者褪黑激素分泌的抑制。中华医学杂志332:6-11,1995。[PubMed]
达西DM,廖华伟。et al。灵长类动物视网膜中表达黑素的神经节细胞信号颜色和辐照度并投射到LGN。Nature.2005; 433(7027): 749 - 54。[PubMed]
Dacey DM, Peterson BB, Robinson FR和Gamlin PD。灵长类动物视网膜中的烟花:体外光动力学揭示了不同的lgn投射神经节细胞类型。神经元37:15-27,2003。[PubMed]
Danilenko KV和Sergeeva OY。增强蓝光对女性生殖激素的直接影响。神经内分泌杂志36:2015。[PubMed]
Dkhissi-Benyahya O, Coutanson C, Knoblauch K, Lahouaoui H, level V, Rey C, Bennis M, Cooper HM。黑视素的缺失改变了视网膜的时钟功能和光对多巴胺的调节。细胞与分子生物学杂志32(3),2013。[PubMed]
Dkhissi-Benyahya O, Gronfier C, De vananssay W, Flamant F和Cooper HM。模拟中波长锥在昼夜节律对光反应中的作用。神经元53:677-687,2007。[PubMed]
Do MT,康世盛,薛涛,钟浩,廖洪伟,Bergles DE,丘坤伟。黑视素视网膜神经节细胞的光子捕获和信号传递。自然457:281-287,2009。[PubMed]
Do MT和Yau KW.视网膜神经节细胞对稳定光的适应。中国生物医学工程学报(自然科学版),2013。[PubMed]
Dollet A, Albrecht U, Cooper HM和Dkhissi-Benyahya O.视锥细胞是对光相移和时钟基因表达的正常时间响应所必需的。时间生物学杂志27:768-781,2010。[PubMed]
道林我。视网膜:大脑中可接近的部分。剑桥(马萨诸塞州):哈佛大学出版社贝尔纳普出版社;1987.
OFF内丛状层的异位视网膜ON双极细胞突触:与多巴胺能无分泌细胞和黑视素神经节细胞的接触。中华神经科学杂志517:226-244,2009。[PubMed]
Ecker JL, Dumitrescu ON, Wong KY, Alum NM, Chen SK, LGates, T, renna JM, Prusky GT, Berson DM和Hattar S(2010)表达黑素的视网膜神经节细胞光受体:细胞多样性及其在模式视觉中的作用。67年神经元,49-60。[PubMed]
黑视蛋白在持续和宽带光转导中的可扭性。神经元。85年3月4日,(5):1043 - 2015。[PubMed]
Estevez ME, Fogerson PM, Ilardi MC, Borghuis BG, Chan E, Weng S, Auferkorte ON, Demb JB, Berson DM. M4细胞的形态和功能,M4细胞是一种本质光敏的视网膜神经节细胞类型,有助于基因皮质视觉。中华神经科学杂志32:1 - 6,2012。[PubMed]
Fain GL, Matthews HR。et al。脊椎动物感光器的适应性。杂志启;2001 81(1):117 - 151。[PubMed]
Famiglietti EV, Jr.和Kolb H.视网膜神经节细胞的on -和OFF-center反应的结构基础。科学194:193-195,1976。[PubMed]
Frazao R, MacMahon DG, Schunack W, Data P, Heidelberger R和Marshak DW(2011)组胺通过H-1受体提高小鼠视网膜多巴胺能细胞中的游离胞内钙。投资。角膜切削。见科学52,3083-3088。
弗里德曼女士,卢卡斯RJ。et al。非杆状,非锥状,眼光感受器对哺乳动物昼夜节律行为的调节。科学。1999;284(5413):502 - 4。PubMed]
傅艳,丘坤华。小鼠杆和锥细胞的光转导。弗鲁格拱门。2007;454(5):805 - 19所示。[PubMed]
傅艳,钟辉,王明明,罗德光,廖华伟,Maeda H, Hattar S, Frishman LJ,丘克伟。视网膜神经节细胞对光的本质感光性与维生素基光色素-黑视素。中国科学:地球科学,2005(3):339- 344。[PubMed]
加斯丁格,m.j., O 'Brian, j.j., Larsen, J.N.J.和Marshak, D.W.(1999)猕猴视网膜中的组胺免疫反应性轴突。投资。Ophthal。见科学40,487-495。
Gooley JJ, Lu j等。视网膜下丘脑束起源细胞中的黑视素。Nat > 2001; 4(12): 1165。[PubMed]
Goz D, Studholme K, Lappi DA, Rollag MD, Provencio I和Morin LP。用saporin结合物靶向破坏光敏视网膜神经节细胞改变了光对小鼠昼夜节律的影响。公共科学图书馆3:e3153, 2008。[PubMed]
Graham DM, Wong KY。et al。黑视素神经节细胞使用膜相关横纹肌光转导级联。J Neurophysiol.2008; 99(5): 2522 - 32。[PubMed]
Grunert U, Jusuf PR, Lee SC和Nguyen DT。灵长类动物视网膜中含有神经节细胞的黑视素的双极输入。神经科学杂志28:39-50,2011。[PubMed]
Guler AD、Ecker JL、Lall GS、Haq S、Altimus CM、Liao HW、Barnard AR、Cahill H、Badea TC、Zhao H、Hankins MW、Berson DM、Lucas RJ、Yau KW和Hattar S是非成像视觉杆锥输入的主要通道。自然453:102-105,2008。[PubMed]
汉金斯MW和卢卡斯RJ。人类的主要视觉通路是通过一种非经典光色素的作用,根据长期的光照调节的。中华生物学杂志12:191-198,2002。[PubMed]
Hannibal J, Georg B, Hindersson P,和scientikrug J.光明和黑暗调节白化病Wistar大鼠视网膜神经节细胞中的黑视素。中华神经科学杂志27:147-155,2005。[PubMed]
汉尼拔J, Hindersson P.等。光色素黑视素只存在于视网膜下丘脑束的垂体腺苷酸环化酶激活多肽视网膜神经节细胞中。J > 2002; 22 (1): RC191。[PubMed]
Hannibal J, Kankipati L, Strang CE, Peterson BB, Dacey D, Gamlin PD。猕猴内在光敏性视网膜神经节细胞的中央投射。神经神经杂志522:2231-2248。[PubMed]
艰苦的RC。黑腹果蝇的光转导。中华实验生物学杂志2001;204(p20): 3403-9。[PubMed]
果蝇的视觉转导。自然。2001;413(6852):186 - 93。[PubMed]
艰苦的RC。果蝇光感受器中的色氨酸通道:脂质连接。细胞钙。2003;33(5 - 6):385 - 93。[PubMed]
艰苦的RC。1,2-双(2-氨基苯氧基)乙烷N,N,N ',N ' -四乙酸(BAPTA)和二溴BAPTA对果蝇光感受器磷脂酶C活性的抑制38细胞钙。2005;(6):547 - 56。[PubMed]
Hatori M, Le H, Vollmers C, Keding SR, Tanaka N, Buch T, Waisman A, Schmedt C, Jegla T,和Panda s。诱导消融表达黑视素的视网膜神经节细胞揭示了它们在非图像形成视觉反应中的核心作用。PLoS One 3: e2451, 2008。[PubMed]
郝德盛,廖华伟。et al。含黑色素视蛋白的视网膜神经节细胞:结构、投射和固有光敏性。科学。2002;295(5557):1065 - 70。PubMed]
哈塔尔S,卢卡斯RJ。et al。黑视素和杆锥光感受系统是小鼠主要的辅助视觉功能。自然。2003;424(6944):76 - 81。[PubMed]
哈特S,库马尔M.等。小鼠视网膜神经节细胞表达黑视素的中央投射。中华神经科学杂志2006;497(3):326-49。[PubMed]
Horiguchi H, Winawer J, Dougherty RF, Wandell BA。人类的三色视觉再现。中国生物医学工程学报(自然科学版),2013。[PubMed]
Hoshi H, Liu WL, Massey SC和Mills SL. OFF层的ON输入:打破视网膜分层规则的双极细胞。中华神经科学杂志29:559 - 561,2009。[PubMed]
胡聪,希尔达东,王基基。五种小鼠神经节细胞光感受器的内在生理特性。中国神经科学杂志32(5):561 - 562,2013。[PubMed]
Iyilikci O, Aydin E, Canbeyli R.黑暗中蓝光刺激对行为绝望有抗抑郁作用,而不是红光刺激。大脑科学杂志203:65-68,2009。[PubMed]
Johnson J, Wu V, Donovan M, Majumdar S, Renteria RC, Porco T, Van Gelder RN和Copenhagen DR.新生小鼠的黑色素素依赖光回避。中国生物工程学报(英文版),2010。[PubMed]
Joo HR, Peterson BB, Dacey DM, Hattar S, Chen SK.视网膜神经节细胞的周期性轴突副。神经科学杂志30:175-182,2013。[PubMed]
Jusuf PR, Lee SC, Hannibal J,和Grunert U.灵长类视网膜中含有黑视素的神经节细胞的表征和突触连通性。中华神经科学杂志26:2906-2921,2007。[PubMed]
人类和小鼠的昼夜光接收。摩尔间歇雨刷。2002;2(8):484 - 92。[PubMed]
基勒,刚建成时(1927年)。盲鼠虹膜运动。点。医学杂志,81,107-112。
基勒C.《家鼠正常和无杆视网膜与光刺激产生的电动势的关系》。中国科学(d辑:自然科学版)1928;[PubMed]
光诱导松果体血清素n -乙酰基转移酶活性的快速降低。科学。1972;177(4048):532 - 533。[PubMed]
诺克斯·贝,索莱西奥·e。中华医学杂志。2006;27(4):355-8。[PubMed]
Lall GS, Revell VL, Momiji H, Al Enezi J, Altimus CM, Guler AD, Aguilar C, Cameron MA, Allender S, Hankins MW和Lucas RJ。杆状、锥状和黑视素感光细胞对编码辐照度的不同贡献。神经元66:417-428,2010。[PubMed]
Larsen PJ, enist LW, Card JP。利用病毒跨神经元追踪对大鼠松果体多突触神经元控制的表征。中华神经科学杂志10:28- 34,1998。[PubMed]
卢卡斯RJ,弗里德曼女士等。非杆状,非锥状,眼感光器对哺乳动物松果体的调节。科学。1999;284(5413):505 - 7。[PubMed]
卢卡斯RJ,哈特S.等。黑视素敲除小鼠在高辐照度下瞳孔光反射减弱。科学。2003;299(5604):245 - 7。[PubMed]
Lupi D, Oster H, Thompson S和Foster RG。睡眠的急性光诱导是由opn4基光接收介导的。神经科学杂志11:1068-1073,2008。[PubMed]
Masland RH。视网膜的细胞群:Proctor讲座。眼科科学52:4581-4591,2011。[PubMed]
Matynia A, Parikh S, Chen B, Kim P, McNeill DS, Nusinowitz S, Evans C, Gorin MB.视网膜神经节细胞本身光敏性是厌恶光的主要但不是唯一的电路。经验眼Res 105: 60-69, 2012。[PubMed]
Meesters Y, Dekker V, Schlangen LJ, Bos EH和Ruiter MJ。低强度蓝白光(750勒克斯)和标准强光(10,000勒克斯)对治疗SAD同样有效。随机对照研究。BMC精神病学11:17,2011。[PubMed]
Melyan Z, Tarttelin EE, Bellingham J, Lucas RJ,和Hankins MW。添加人黑视蛋白使哺乳动物细胞具有光敏性。自然学报433:741-745,2005。[PubMed]
摩根WW和坎普CW。光感受器变性大鼠视网膜的多巴胺能无分泌神经元继续对光产生反应。生命科学26:1619-1626,1980。[PubMed]
Morin LP和Studholme KM。经典细胞和神经节细胞光感受器在昼夜节律夹带和光嗜睡诱导方面的功能分离。神经科学199:213-224,2011。[PubMed]
黑素敲除小鼠对光的遮蔽反应受损。时间生物学杂志20:989-999,2003。[PubMed]
Muindi F, Zeitzer JM, Colas D和Heller HC。光对小鼠在黑暗期睡眠的急性影响:黑视素对维持光诱导睡眠的重要性。中华神经科学杂志,32(4):361 - 361,2013。[PubMed]
Muller LP, Do MT, Yau KW, He S和Baldridge WH。小鼠视网膜内感光性视网膜神经节细胞与无分泌细胞的示踪偶联。中华神经科学杂志(英文版),2010。[PubMed]
Nelson R, Famiglietti EV, Jr.和Kolb H.细胞内染色揭示了猫视网膜上和非中心神经节细胞的不同层次分层。中华神经科学杂志41:442 -483,1978。[PubMed]
诺伊曼S,哈弗坎普S,和奥弗科特昂。灵长类动物视网膜的感光神经节细胞表达不同的抑制性神经递质受体组合。神经科学199:24-31,2011。[PubMed]
Noseda R, Kainz V, Jakubowski M, Gooley JJ, Saper CB, Digre K, Burstein R.光加剧头痛的神经机制。神经科学杂志13:239-245,2010。[PubMed]
包W,希尔DD,黄KY。褪黑素调节m4型神经节细胞感光器。神经科学303:178-188,2015。[PubMed]
熊猫S,佐藤TK。et al。黑视素(Opn4)在正常光诱导的昼夜相移中的需求。科学。2002;298(5601):2213 - 6。[PubMed]
Panda S, Provencio I.等。黑视素是盲小鼠非成像光反应所必需的。科学。2003;301(5632):525 - 7。[PubMed]
Panda S, Nayak SK.等。黑视素信号通路的照明。科学。2005;307(5709):600 - 4。[PubMed]
Perez-Leon JA, Warren EJ。et al。突触输入到视网膜神经节细胞,设置昼夜节律时钟。中华神经科学杂志2006;24(4):1117-23。[PubMed]
帕尔曼一世和诺曼一世。脊椎动物光感受器的光适应与感光控制机制。视网膜眼科杂志17:523-563,1998。[PubMed]
神经节细胞光感受器向多巴胺能无分泌神经元信号传递的突触前和突触后机制。见:视觉与眼科学研究协会,2015。
Prigge CL, Yeh PT, Liou NF, Lee CC, You SF, Liu LL, McNeill DS, Chew KS, Hattar S, Chen SK, Zhang DQ。M1 ipRGCs通过视网膜中的逆行信号影响视觉功能。神经科学杂志7月6日;36(27):7184-97,2016。[PubMed]
普罗文西奥一世,蒋罡等。黑视蛋白:黑色素细胞、大脑和眼睛中的视蛋白。中国科学(d辑:自然科学版)1998;[PubMed]
普罗文西奥一世,罗德里格斯一世。et al。视网膜内的一种新的人眼视蛋白。J >。2000;20(2):600 - 5。[PubMed]
普罗文西奥一世,Rollag md等。哺乳动物视网膜中的感光网。这种细胞网状结构也许可以解释为什么一些失明的老鼠仍然可以分辨白天和夜晚。Nature.2002; 415(6871): 493。[PubMed]
邱X, Kumbalasiri T.等。异源表达黑视蛋白诱导光敏性。大自然。2005;433(7027):745 - 9。[PubMed]
饶S,淳C,范j, Kofron JM,杨MB, Hegde RS, Ferrara N, Copenhagen DR, Lang RA。一种直接的和依赖黑视素的胎儿光反应调节小鼠的眼睛发育。自然494:243-246,2013。[PubMed]
Reifler AN, Chervenak AP, Dolikian ME, Benenati BA, Meyers BS, Demertzis ZD, Lynch AM, Li BY, Wachter RD, Abufarha FS, Dulka EA, Pack W, Zhao X,和Wong KY。大鼠视网膜有五种神经节细胞感光器。经验眼Res 130: 17-28, 2015。[PubMed]
Reifer AN, Chervenak AP, Dolikian ME, Benenati BA, Li BY, Wachter RD, Lynch AM, Demertzis ZD, Meyers BS, Abufarha FS, Jaeckel ER, Flannery MP, Wong KY。所有在移位的无分泌细胞上持续的尖突,都接受来自米兰sin神经节细胞的间隙连接输入。当前医学杂志。11月2日,25(21):2763 - 73年,2015年。[PubMed]
Renna JM, Weng S, Berson DM.光通过黑视蛋白作用,改变视网膜波和视网膜致弯传入物的分离。神经科学杂志14:827-829,2011。[PubMed]
在哺乳动物视网膜中,昼夜节律时钟和光/暗适应对腺苷有不同的调节作用。神经科学杂志25:215-222,2005。[PubMed]
鲁比·NF,布伦南TJ。et al。黑视素在昼夜对光反应中的作用。科学。2002;298(5601):2211 - 3。[PubMed]
酒井HM,中坂K,道林JE。鲶鱼视网膜的神经节细胞树突是突触前的。自然319:495-497,1986。[PubMed]
Sakamoto K, Liu C, Kasamatsu M, Pozdeyev NV, Iuvone PM, Tosini G.多巴胺调节内源性光敏视网膜神经节细胞黑视素mRNA的表达。欧洲神经科学杂志22:3129-3136,2005。[PubMed]
Sakamoto K, Liu C,和Tosini G.经典光感受器调节大鼠视网膜中的黑视素mRNA水平。神经科学杂志24:9693-9697,2004。[PubMed]
Schmidt TM, Alam NM, Chen S, Kofuji P, Li W, Prusky GT, Hattar S。黑视素在alpha视网膜神经节细胞和对比检测中的作用。神经元82:781-788,2014。[PubMed]
差异锥通路对视网膜神经节细胞亚型的影响。神经科学杂志30:1662 - 1671,2010。[PubMed]
本质光敏性视网膜神经节细胞的功能和形态差异。神经科学杂志29:476-482,2009。[PubMed]
Schmidt TM, Taniguchi K和Kofuji P.小鼠发育过程中表达黑视素的神经节细胞的内外光反应。神经生理杂志(英文版),2008。[PubMed]
Sekaran S, Foster RG。et al。钙成像揭示了视网膜内部感光神经元的网络。咕咕叫医学杂志。2003;13(15):1290 - 8。[PubMed]
Sekaran S, Lupi D, Jones SL, Sheely CJ, Hattar S, Yau KW, Lucas RJ, Foster RG,和Hankins MW。黑色素视蛋白依赖的光接收提供了哺乳动物视网膜中最早的光检测。中华生物学报15:1099-1107,2005。[PubMed]
Shimazoe T, Morita M, Ogiwara S, Kojiya T, Goto J, Kamakura M, Moriya T, Shinohara K, Takiguchi S, Kono A, Miyasaka K, Funakoshi A, Ikeda M胆囊收缩素-A受体调节光输入通路到昼夜时钟。中国生物医学工程学报32(4):559 - 561,2008。[PubMed]
Sikka G, Hussmann GP, Pandey D, Cao S, Hori D, Park JT, Steppan J, Kim JH, Barodka V, Myers AC, Santhanam L, Nyhan D, Halushka MK, Koehler RC, Snyder SH, Shimoda LA和Berkowitz DE.黑视素介导血管中的光依赖性放松。中国生物医学工程学报(英文版),2014。[PubMed]
Sodhi P和Hartwick AT。腺苷通过camp介导的通路调节大鼠视网膜神经节细胞光感受器的光反应。中国生物医学工程学报(英文版),2014。[PubMed]
徐建平,井上田等。PtdIns(4,5)P2门KCNQ离子通道的快速化学诱导变化。科学。2006;314(5804):1454 - 7。[PubMed]
Tarttelin EE, Bellingham J, Bibb LC, Foster RG, Hankins MW, Gregory-Evans K, Gregory-Evans CY, Wells DJ和Lucas RJ。视蛋白基因在人和小鼠眼部发育早期的表达。Exp Eye Res 76: 393-396, 2003。[PubMed]
Thapan K, Arendt J和Skene DJ。褪黑素抑制的作用谱:人类一种新的非杆状、非锥状感光系统的证据。中国生物医学工程学报(英文版),2001。[PubMed]
Tsai JW, Hannibal J, Hagiwara G, Colas D, Ruppert E, Ruby NF, Heller HC, Franken P,和Bourgin P.黑视素作为睡眠调节因子:光对睡眠的直接影响和改变Opn4(-/-)小鼠的睡眠稳态的昼夜门控。生物学报7:e1000125, 2009。[PubMed]
涂dc,张东等。内在光敏性视网膜神经节细胞的生理多样性与发育。神经元。2005年,48(6):987 - 99。[PubMed]
范盖尔德RN,吉布勒TM。et al。隐色素1和2对自由奔跑和光夹带小鼠昼夜节律的多效作用。J Neurogenet.2002; 16(3): 181 - 203。[PubMed]
非视光接收:无视光感知。咕咕叫医学杂志。2008;18 (1):R38-R39。[PubMed]
大鼠神经节细胞光感受器的多巴胺能调节。中华神经科学杂志35:507-518,2012。(PubMed)
Vandewalle G, Collignon O, Hull JT, Daneault V, Albouy G, Lepore F, Phillips C, Doyon J, Czeisler CA, Dumont M, Lockley SW和Carrier J蓝光刺激视盲个体的认知大脑活动。中华认知神经科学杂志25:2072-2085,2013。[PubMed]
Vandewalle G, Gais S, Schabus M, Balteau E, Carrier J, Darsaud A, Sterpenich V, Albouy G, Dijk DJ,和Maquet P.波长依赖性调节大脑对白天光暴露工作记忆任务的反应。大脑皮层17:2788-2795,2007。[PubMed]
Vartanian GV, Li BY, Chervenak AP, Walch OJ, Pack W, Ala-Laurila P, Wong KY。光对人类褪黑素的抑制比以前报道的更敏感。中华生物医学杂志30:351-354,2015。[PubMed]
维尼TJ, Balint K.等。通过跨突触病毒追踪发现含有黑视素的神经节细胞的视网膜局部回路。咕咕叫医学杂志。2007;17(11):981 - 8。PubMed]
Viola AU, James LM, Schlangen LJ, Dijk DJ。工作场所富含蓝色的白光可以提高自我报告的警觉性、表现和睡眠质量。工作环境卫生杂志34:297-306,2008。[PubMed]
Vugler AA, Redgrave P, Hewson-Stoate NJ, Greenwood J和Coffey PJ。持续的光照导致正常视网膜和退化视网膜的空间离散多巴胺消耗。神经化学杂志33:9-22,2007。[PubMed]
Vugler AA, Redgrave P.等。在正常和退化的视网膜中,多巴胺神经元与黑视素细胞形成一个离散的神经丛。实验神经。2007;205(1):26 - 35周不等。[PubMed]
Walker MT, Brown RL, Cronin TW和Robinson PR.小鼠黑视素视网膜发色团的光化学。中国生物医学工程学报(英文版),2008。[PubMed]
小鼠神经节细胞光感受器受最敏感的杆状通路和两种视锥细胞的驱动。公共科学图书馆8:e66480, 2013。[PubMed]
翁山,王基基,Berson DM.大鼠神经节细胞光感受器中黑素驱动光反应的昼夜调节。生物学杂志24:391-402,2009。[PubMed]
王基,邓发。et al。感光性视网膜神经节细胞的光感受器适应。神经元。2005年,48(6):1001 - 10。[PubMed]
王基,邓发。et al。突触对大鼠神经节细胞感光器的影响。物理学报,2007;582(Pt 1): 279-96。[PubMed]
王肯塔基州。一种视网膜神经节细胞,能连续10小时发出辐射信号。神经科学杂志32:1 - 4,2012。[PubMed]
薛涛,Do MT, Riccio A,蒋卓,Hsieh J, Wang HC, Merbs SL, Welsbie DS, Yoshioka T, Weissgerber P, Stolz S,絮凝子V, Freichel M, Simon MI, Clapham DE, Yau KW.哺乳动物虹膜和视网膜中的黑色素视蛋白信号。自然479:67-73,2011。[PubMed]
Zaidi FH, Hull JT, Peirson SN, Wulff K, Aeschbach D, Gooley JJ, Brainard GC, Gregory-Evans K, Rizzo JF, 3rd, Czeisler CA, Foster RG, Moseley MJ和Lockley SW。缺乏外部视网膜的人的昼夜节律、瞳孔和视觉意识的短波光敏感性。生物学报17:2122-2128,2007。[PubMed]
张dq, Belenky MA, Sollars PJ, Pickard GE, McMahon DG。黑视素调节视网膜中的逆行视觉信号。PLoS One 7: e42647, 2012。[PubMed]
张dq, Wong KY, Sollars PJ, Berson DM, Pickard GE, McMahon DG。神经节细胞光感受器向多巴胺能无分泌神经元的视网膜内信号。中国生物医学工程学报(英文版),2008。[PubMed]
张德强,周振江等。视网膜多巴胺能神经元在视觉中多重作用的功能异质性。J >。2007;27(3):692 - 9。PubMed]
赵X, Stafford BK, Godin AL, King WM, Wong KY。五种内在光敏性视网膜神经节细胞的光响应多样性。中国生物医学工程学报(英文版),2014。[PubMed]
赵X,包,W,汗NW,王ky。视网膜内光接收时间的延长取决于视维甲酸周期。J >。2016年4月13日;36(15):4209-17。[PubMed]
2016年11月20日更新
作者
王权博士在香港长大,当时香港还是英国殖民地。他在德克萨斯大学奥斯汀分校(University of Texas at Austin)的本科专业是生物化学,当他开始在哈佛大学(Harvard)攻读博士学位时,他坚信自己想要研究癌症生物学。但在约翰·道林(John Dowling)教授的实验室进行的一次令人非常满意的轮转工作,将权永吸引到了神经生理学的世界,从那时起他就一直在研究视觉系统。beplay体育公司在他的博士论文中,他研究了鱼视网膜中光受体-双极细胞突触中的谷氨酸受体和转运体。然后,在2002年的神经科学学会会议上,他看到了David Berson教授关于黑视素表达神经节细胞的精彩演讲,这是一种与非图像形成的视觉行为有关的新型视网膜感光细胞。听到这番话,权伟决定跟随布朗大学的伯森教授进行博士后研究。在Kwoon在Berson实验室的6年里,他研究了黑视素神经节细胞的光反应和突触回路。自2010年1月以来,他一直是密歇根大学的助理教授,在那里他继续研究这些奇异的神经节细胞。
达斯汀·m·格雷厄姆博士出生于加利福尼亚州的普莱森顿,并在布朗大学获得了神经科学博士学位。他在圣克拉拉大学大卫·陶克博士的实验室开始了他的研究生涯,研究池塘蜗牛学习和记忆的神经通路。在与美国国立卫生研究院的拉尔夫·纳尔逊博士合作期间,他的兴趣转向了视网膜。在那里,他帮助开发了一种快速标记技术,以描绘斑马鱼视网膜神经元的形态亚型。作为研究生,达斯汀在大卫·伯森博士的实验室里研究哺乳动物的昼夜节律和新发现的黑视素神经节细胞活性。他专注于ipRGCs中的光转导级联,并开发了一种分离和培养程序来识别和记录来自分离的ipRGCs的光反应。达斯汀在弗吉尼亚大学心理系和纽约州立大学石溪分校神经生物学与行为系获得了研究奖学金。他目前是纽约自然出版集团的编辑。