奥拉夫施特劳斯
1.介绍。
最简单的光探测器官由两种细胞组成:光敏感感光细胞和色素细胞。这两种细胞类型同时出现在从昆虫、软体动物到高级脊椎动物的动物王国里。色素细胞和光感受器细胞之间的相互作用对视觉功能至关重要[2-5]。早在胚胎发育阶段,光感受器层和视网膜色素上皮层(RPE)的功能分化就相互依赖[6,7]。当发育中的RPE与发育中的神经元视网膜之间的通信中断时,RPE能够自行形成多层视网膜样结构[8]。
RPE和神经视网膜在眼睛发育过程中共分化。RPE/光感受器相互作用的部分,如导入维生素A衍生物,视网膜,其代谢和循环在视力开始前就开始了,并作为两种组织的分化信号[9,10]。此外,对视网膜变性的遗传类型的分析显示RPE对光感受器有很强的依赖性,反之亦然。例如,光感受器细胞中表达的基因突变可导致原发性RPE疾病,继发光感受器丧失。另一方面,RPE中表达的基因突变可能导致原发性光感受器变性。因此,光感受器细胞探测光的能力取决于它与色素细胞的相互作用。
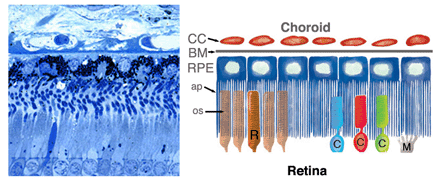
图1。人视网膜色素上皮的光镜照片(左),上面是脉络膜,下面是视网膜。视网膜色素上皮(RPE)(右)与显微图像对齐。CC, choirocapillaris;BM,布鲁赫膜;RPE,视网膜色素上皮;美联社,顶端流程;操作系统,外段;C,锥;R,棒; M, Muller cells
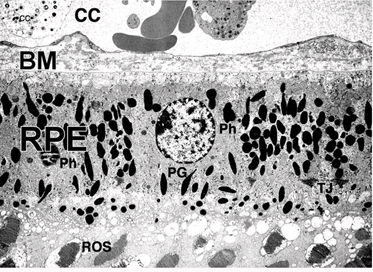
图2。正常人供眼RPE细胞和RPE-脉络膜界面的透射电镜图。CC, choirocapillaris;BM,布鲁赫膜;RPE,视网膜色素上皮;ros,外段;ph值、时间;pg,色素颗粒
在脊椎动物的眼睛中,RPE位于光感受器的感光外节段和脉络膜的血液供应之间。它是一个六边形排列、紧密连接、连接的单层细胞,含有色素颗粒(图1和图2,PG)和消化光感受器外段膜为吞噬体的细胞器(图2,吞噬体,Ph)。它的顶端膜和突起(图1,ap)面向视网膜下空间,视网膜下空间由细胞外基质所占据,该细胞外基质专门用于实现RPE和光感受器的光敏外节段之间的相互作用(图1和2,os, ros)[11-14]。RPE的基底外侧膜与高度特化的多层Bruch 's膜(图1和图2)接触,这也代表了RPE与脉络膜(绒毛膜,CC图1和图2)中有孔的血管中的血流的相互作用矩阵。
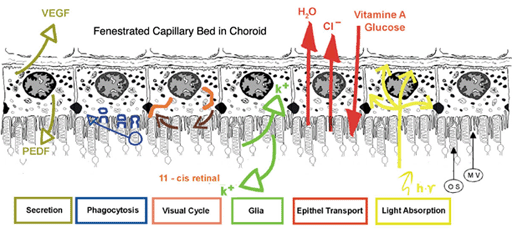
图3显示了色素上皮及其功能属性的概要图,这将在下一章中讨论。
图3。RPE的主要功能简图(来自Strauss, 2005[2])。
其功能包括:光吸收、上皮运输、空间离子缓冲、视觉循环、吞噬、分泌和免疫调节。
2.吸收的光。
乍一看,光吸收是RPE最明显的功能。这些细胞色素丰富,覆盖在球根的内表面。就像照相机一样,它通过吸收散射光来提高眼睛光学系统的质量。在很长一段时间里,这一功能被认为是RPE的唯一功能。现在我们知道了RPE的许多其他功能(见上图3)。
在人眼中,光线通过晶状体聚焦到黄斑细胞上,从而在视网膜中产生高浓度的光氧化能量[16-18]。此外,脉络膜是一种比肾脏具有更高特异性血液灌注的组织[19-22]。但是,视网膜在通过脉络膜时的氧气提取相对较低。脉络膜的静脉血氧饱和度仍超过90%。因此,RPE从视网膜一侧暴露在强光氧化能量下,从血液一侧暴露在氧气溢出下。光氧化会导致光感受器外节尖端的损伤,因此它们需要从基部不断更新(见第二部分,Webvision的光感受器章节)(在下面第6节中描述)。然而,更新过程涉及RPE对被破坏和脱落的光感受器外节的吞噬。除了高光氧化环境外,这还增加了大量的自由基。因此,RPE必须能够通过对自由基、光氧化暴露和光能的有效防御来维持视网膜结构的完整性[16-18]。
为此,RPE有几道防线,第一道防线是黑素小体或色素颗粒[17]。根据明暗循环,它们在光照条件下移动到细胞质内的顶端突。黑素体吸收的光使RPE/脉络膜复合体升温到40℃以上o
C(23、24)。脉络膜的高灌注可能是为了将视网膜上的热量输送出去。进一步的防线是高浓度的非酶和酶抗氧化剂,以及细胞修复受损脂质、蛋白质和DNA的能力。在人类中,这些机制为光感受器/RPE/脉络膜复合体提供保护,并在几十年的时间里维持该复合体的结构完整性。然而,众所周知,人的视网膜在其一生中,从年轻时就开始积累脂褐素(吞噬体分解的最终产物)。这种积累削弱了RPE细胞,随着时间的推移,它们的防线变得越来越弱[17,25 -29]。据信,吸收光线和补偿氧化损伤的能力下降是引发老年人群中年龄相关性黄斑变性发病的一系列事件的重要因素(参见Hageman等人在Webvision的AMD章节)。
3.上皮运输。
所以RPE形成了一个紧密连接的上皮细胞,位于脉络膜的血流和光感受器的外节段之间。六方上皮片的外侧表面之间存在紧密连接(图2,TJ)[4,30,31]。通过这种方式,RPE形成了血液/视网膜屏障的一部分。紧密上皮细胞的屏障功能意味着可以有效地将视网膜内部与脉络膜侧的全身影响隔离开来。这对于眼睛的免疫特权(见第8节)和血液与视网膜下间隙之间的高选择性运输非常重要。这种上皮运输的作用是向光感受器提供营养物质(从血液运输到视网膜侧),控制视网膜下空间的离子稳态,并从视网膜组织中消除水和代谢物(从视网膜运输到血液侧)。
输送:从血液侧到视网膜的运输:
光感受器是高度特化的细胞,需要提供必需的代谢物。它们是葡萄糖用于能量代谢,视网膜用于视蛋白的视觉循环,ω-3脂肪酸用于组成高度富含ω-3脂肪酸的光感受器膜的特殊磷脂。所有这些营养物质都被RPE吸收,并被运送到光感受器。为了运输葡萄糖,RPE在根尖和基底外侧膜均表达葡萄糖转运蛋白GLUT1和GLUT3[32,33]。GLUT3负责基本运输,而GLUT1负责诱导运输系统,以满足代谢需要。视网膜的转运始于从血液中摄取视黄醇,然后被转移到视网膜的视觉循环中,具体过程如下(第5节)。为了转运ω-3脂肪酸,RPE优先以浓度依赖性的方式吸收22:6 ω-3脂肪酸[34,35]。在RPE内,该化合物被纳入甘油脂中进行合成、储存和随后在包含吞噬过程的循环过程中输送(见第6节)。
从视网膜下空间到血液侧的运输:
主要是水、离子和代谢终产物从视网膜侧运输到血液侧[4,30,31,36,37]。视网膜是人体细胞密度最高的组织。光感受器、神经元和神经胶质细胞具有很高的代谢翻转率,导致代谢水的产生,并在视网膜中积累。此外,眼内压促使水从眼前流向视网膜,在那里聚集。此外,视网膜细胞的大部分代谢活动导致乳酸的产生。据报道,在视网膜下间隙[38]中乳酸浓度高达19mm。
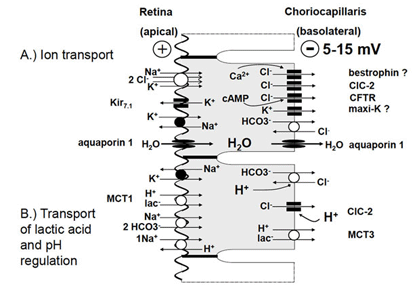
图4。RPE细胞的上皮转运和pH调节。A.离子在RPE上的经上皮转运:Cl- - - - - -主要从视网膜下间隙转移到绒毛膜小毛膜。这种运输使水通过水通道从视网膜下间隙到达绒毛膜小毛膜。上皮细胞运输的动力是由位于顶端的Na提供的+/ K+腺苷三磷酸酶。K+atp酶通过根尖膜循环运输,促进Na的建立+渐变到单元格。Na+梯度驱动K的吸收+和Cl- - - - - -导致细胞内Cl含量高- - - - - -活动。Cl- - - - - -从细胞基底外侧通过Cl- - - - - -频道。Cl效率- - - - - -Cl的活性降低了细胞的挤压作用- - - - - -/ HCO3- - - - - -交换氯- - - - - -回牢房去。B)乳酸的运输和pH值的调节:乳酸被乳酸胶从视网膜下间隙排出- - - - - -/小时+转运蛋白。乳酸通过基底外侧膜使用不同亚型的乳酸-/H离开细胞+转运蛋白。必要的pH调节发生在钠+/小时+交换器和Na+/ HCO3- - - - - -根尖膜上有一个交换器和一个Cl- - - - - -/ HCO3- - - - - -基底外侧膜上的交换器。Cl的活性- - - - - -/ HCO3- - - - - -交换器由基底外侧Cl支撑- - - - - -通道导致Cl的循环- - - - - -穿过基底外侧膜。在细胞内酸化的情况下,Cl- - - - - -/ HCO3- - - - - -而Cl- - - - - -通道被激活。这增加了净水运输。缩写:ClC- - - - - -2、Cl家族的电压依赖性Cl通道;CFTR,囊性纤维化跨膜电导调节剂;基尔7.1,内正K+频道7.1;最大k,大电导Ca2 +端依赖K+通道;MCT1,单羧酸转运蛋白1;单羧酸盐转运蛋白(来自施特劳斯,2005[2])。
通过RPE的主动运输,水从视网膜下空间被排除。输运率估计为1.4 ~ 11 μ l × cm-2 × h-1[39-41]。这种水的运输是由Cl-的经上皮运输通过RPE从视网膜下间隙到血侧所驱动的(图4A)。Cl-转运是一种由顶部定位的Na+/K+-ATP酶活性驱动的主动转运,它利用ATP的能量向RPE细胞外转运3个Na+以换取2个Ka+。K+离子通过顶部定位的Kir7.1向内整流K+通道进入视网膜下间隙[42],进入细胞质循环。这导致了Na+进入RPE细胞的梯度,RPE细胞内Na+浓度较低。K+通过向内整流K+通道回收到视网膜下间隙,通过Na+/K+- atp酶提高运输效率,因为它降低了K+在RPE[43]顶端膜的梯度。Na+/K+- atp酶位于顶端的原因尚不清楚。正如下面将在第4节解释的那样,它可能通过离子的空间缓冲来维持视网膜下空间的离子稳态。cl驱动的水运输在RPE和神经元视网膜之间建立了粘附力,通过使用Ouabain[44]阻断Na+/K+- atp酶去除粘附力。
转运途径开始于Cl-从视网膜下间隙穿过RPE细胞顶端膜的摄取。在Na+/K+- atp酶建立的Na+梯度的驱动下,Cl-通过Na+/K+/2Cl-共转运体的活性穿过根尖膜进入细胞[4,30,36,45]。由于K+通过根尖向内整流通道回收到视网膜下间隙,Na+通过Na+/K+- atp酶运输出细胞,Na+/K+/2Cl-共转运体的运输活性主要导致Cl-在RPE细胞内的积累。根据不同的物种,细胞内Cl-活性范围为20 - 60mm[46-48]。由于基底外膜有很大的Cl-电导,Cl-在RPE的细胞内积累,穿过基底外膜离开细胞,进入血侧。这导致基底外侧上皮转移电位为负,范围在5 - 15mv之间[30,31]。
这一转运途径的关键一步是Cl-的基底外侧膜电导。因此,调节穿过基底外侧膜的外排通路的机制调节了Cl-通过RPE的整体上皮运输。为此,不同类型的Cl-通道定位于基底外侧膜,其将Cl-电导连接到RPE细胞不同的第二信使通路的激活机制不同。Cl- 2通道[49]似乎提供了一个基本的传输速率。
在一个ClC-2 Cl-通道的敲除小鼠模型中,观察到细胞间上皮电位的缺失,小鼠失明,显示出与色色性视网膜炎[49]相似的表型。其他基外侧Cl-通道可能是CFTR(囊性纤维化跨膜调节剂),它可通过camp调节跨基外侧膜的Cl-转运[50,51],以及Ca2+依赖的Cl-通道,它可通过细胞内Ca2+的变化调节转运。这个Cl-通道的分子特征可能是bestrophin-1[52]。
如上所述,代谢活动导致视网膜下间隙产生大量乳酸。乳酸被RPE从视网膜下间隙排出[37,53](图4B)。乳酸通过单羧酸转运蛋白-1 MCT1在RPE的顶膜上摄取,乳酸通过基底外侧膜通过单羧酸转运蛋白-3 (MCT3)的活性释放到血侧。乳酸的运输需要有效的pH调节和适应体积运输,因为大量运输的水是代谢水。RPE细胞的pH调节与Na的活性有关+RPE的根尖膜耦合的次生主动转运机制[54,55]。H+钠离子从细胞质中除去+/小时+换热器和HCO3- - - - - -在胞浆中通过Na+/ 2 hco3- - - - - -co-transporter[56]。在RPE的基底外侧膜上,有一个HCO3- - - - - -/ Cl- - - - - -交换器干扰细胞内HCO3的控制- - - - - -根尖纳+/ 2 hco3- - - - - -co-transporter。在高pH值时,RPE输送HCO3- - - - - -从视网膜下间隙到血液侧。在低pH值时,基底侧HCO3- - - - - -/ Cl- - - - - -交换器受到刺激,细胞内HCO3增加- - - - - -浓度和HCO3- - - - - -由钠的活性通过根尖膜释放到视网膜下间隙+/ HCO3- - - - - -协同传输器,然后以反向模式运行。
基底外侧膜上HCO3-/Cl-交换器的参与将水的运输与pH调节联系在一起,从而与乳酸的运输联系在一起[46,47,56 -62]。在静息状态下,基底外侧膜上的HCO3-/Cl-交换器降低了Cl-在基底外侧膜上的运输速率,因此,减少了体积的跨上皮运输,因为少量Cl-通过基底外侧Cl-通道,在HCO3-/Cl-交换器的活性下被运输回细胞内空间。在低pH值时,HCO3-/Cl-交换器将Cl-运输出细胞,吸收HCO3-进行pH调节,这反过来导致Cl-和体积运输的增加。基底外侧ClC-2 Cl通道的pH敏感性支持了这一点,该通道通过降低细胞外pH值而增加其活性。体积的运输与HCO3-运输有关,这一事实被用于黄斑水肿的治疗。应用碳酸酐酶抑制剂可通过RPE提高体积吸收速度[62,63]。渗透性物质通过RPE从视网膜下间隙到血液侧的运输建立了水通过RPE的渗透驱动力。
RPE是一个紧密的上皮细胞,这意味着水的运输不能通过任何细胞旁运输途径发生。所有运输的体积都必须走跨细胞路线。为此,RPE表达位于RPE基底外侧和根尖膜上的水通道-1[64,65]。然而,也有人认为单羧酸盐转运蛋白能够运输水。
4.离子的空间缓冲
如上所述,RPE通过上皮细胞对离子的运输来维持视网膜下空间的离子稳态。然而,光感受器活性和二阶神经元活性的光依赖性变化导致视网膜下空间发生非常快速的变化,这需要RPE进行快速的容性补偿[66]。如果这些变化没有得到补偿,光感受器和神经元的整体兴奋性将迅速改变,视觉信息的正确信号转导将不可能实现。正常的离子经上皮运输速度太慢,不足以迅速补偿这些变化。
基于电压依赖性离子通道活动的其他机制增加了基本的离子经上皮运输。在这一过程中,对视网膜下K+浓度和视网膜体积变化的补偿是最重要的。在黑暗中,cgmp门控的阳离子通道在光感受器的外段打开。通过这些通道流入的Na+和Ca2+被内部段流出的K+所平衡。这些离子电流就是所谓的暗电流[67]。当光落在光感受器外段时,cgmp依赖性的阳离子通道关闭,K+流出在内段变小。同时,内段的Na+/K+- atp酶吸收K+进入感光细胞。这导致视网膜下间隙K+浓度从5 mM降低到2 mM[4,66]。这一减少额由RPE补偿。这一机制是基于RPE顶部膜的离子电导由K+电导[36]支配。 The light-induced decrease in the subretinal K+ concentration leads to hyperpolarization of the apical RPE membrane. This in turn leads to activation of inward rectifier K+ channels generating an efflux of K+ into the subretinal space, and to an increase of the subretinal K+ concentration back to normal values [68]. For this purpose the RPE expresses Kir7.1 channels located in the apical membrane of the RPE [69]. Kir7.1 channels were found to display a rather mild rectification but show increased conductance when extracellular K+ is decreased. This makes these K+ channels the ideal candidates for this function [42, 70]. This compensatory pathway enables fast reactions of the RPE to either decreases or increase in the subretinal K+ concentration.
LaCour开发的一个模型解释了在控制条件下,由上皮运输引起的K+浓度变化的补偿是通过相当小的K+经上皮运输从视网膜下间隙到血侧[68,71]。K+的主要部分通过Na+/K+/2Cl-共转运体的活性被带过根尖膜,通过根尖K+通道回收回视网膜下间隙。更小的一部分穿过基底外侧膜离开细胞到血液侧。在视网膜下K+浓度降低的情况下,K+的根尖膜电导增加。这导致K+循环回到视网膜下间隙的比例增加,随后,进一步减少由RPE经上皮运输K+。在视网膜下K+浓度增加的情况下,由于Kir7.1通道失活和根尖膜去极化,根尖膜电导降低。现在一小部分K+被吸过顶端膜可以循环回到视网膜下间隙。这增加了K+的数量,通过RPE运输到血液侧。由于K+浓度与根尖跨膜电位和离子电导的快速耦合,RPE能够对视网膜下K+浓度的变化做出快速反应。
当视网膜受到光刺激时,可以观察到视网膜细胞外体积的微小而短暂的变化[36,72]。这些变化由内视网膜的MŸller胶质细胞和外视网膜的RPE补偿。补偿机制是一种快速反应增加了RPE持续的经上皮运输,在这种情况下是水的运输。快速耦合再次通过电压依赖性的离子传输调制实现。如上所述,水进入RPE的运输是由Cl的经上皮运输驱动的,Cl与hco3和乳酸的运输有关。水运输的光依赖性调节是基于顶部Na+/HCO3-共转运体具有电致性这一事实。这意味着这种运输活动不是电中性的,因为它不运输等量的正电荷和负电荷[56,73 -75]。根尖膜的光依赖性超极化降低了Na+/HCO3-共转运体的转运率,进而导致细胞内酸化。如上所述,细胞内酸化可增强水的运输,导致Cl-通过RPE的基底外侧膜流出增加。
5.视觉周期
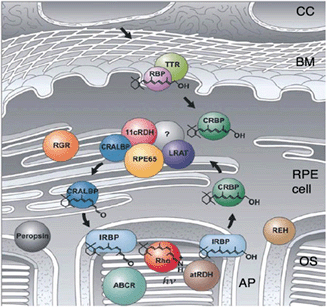
视觉开始于光子被11-顺式视网膜视紫红质的发色团吸收[67,76 -78]。吸收光子后,11-顺式视网膜改变其构象为全反式视网膜,视紫红质在一定时间内变成后视紫红质,直到其活性被磷酸化终止。经过额外的反应步骤后,视紫红质能够将全反式视网膜转换为11-顺式视网膜,并可被光子再次激活。因此,全反式视网膜需要重新异构化,以确保11-顺式视网膜能够满足所有视觉需求和正常的视觉功能[1,79]。由于光感受器不表达全反式视网膜的再异构酶,所以再异构化发生在RPE中。为此,全反式视网膜被运送到RPE,再异构化为11-顺式视网膜并运送回光感受器。这个过程被称为视网膜的视觉周期[80-82,也参见Webvision中关于光转导的第五部分]。视杆细胞的视觉循环通过RPE发生(图5)。视锥细胞的视觉循环不太清楚。可能是部分锥体全反式视网膜被RPE回收,部分被穆勒胶质细胞回收。
图5。视觉周期(改编自汤普森和盖尔(597)。光转导始于视紫红质对光子的吸收。光吸收过程是11-顺式视网膜向全反式视网膜立体化学变化的基础。全反式视网膜被代谢成全反式视黄醇并运输到RPE。在RPE中视黄醇再异构化为11-顺式视网膜,然后再传递到光感受器。这种再生似乎有两条途径。一种是通过一种尚未确定的酶发生的,这种酶被认为是一种同分异构体水解酶。第二种途径涉及光依赖途径,使用rpe -视网膜g蛋白偶联受体,在光吸收后将全反式视网膜异构化为11-顺式视网膜。缩写:CC, choidocapillaris; BM, Bruchs membrane; OS, outer segments; AP, apical processes; IRBP, interstitial retinal binding protein; CRBP, cellular retinol binding protein; CRALBP, cellular retinaldehyde binding protein; atRDH, all-trans retinol dehydrogenase; 11cRDH, 11cis retinol dehydrogenase; LRAT, lecithin retinol acyltransferase; RPE65, RPE specific protein with MD 65 kD; RGR, RPE-retinal G-protein coupled receptor; RBP/TTR, retinol-binding protein/transthyretin complex. (Adapted from Thompson and Gal, 2003 [132]).
视杆细胞的视觉循环开始于外节段的椎间盘,全反式视网膜通过atp驱动的翻转酶ABCR或ABCA4 (atp结合盒蛋白)从椎间盘内间隙转移到视杆外节段的胞质间隙。这一步涉及到全视网膜与磷脂酰乙醇胺反应到n -视黄碱-磷脂酰乙醇胺。下一步,全反式视网膜被膜结合的视黄醇脱氢酶还原为全反式视黄醇,并被运送到视网膜下间隙,在那里它被装载到IRBP(间质视网膜结合蛋白),一种载体蛋白,并运输到RPE。全反式视黄醇被摄取到RPE后被转移到CRBP(细胞视黄醇结合蛋白),CRBP将全反式视黄醇传递到几种酶的蛋白质复合体。该复合物由LRAT(卵磷脂:视黄醇转移酶)、RPE65 (65 kDa的RPE蛋白)和RDH5(11-顺式视黄醇脱氢酶)组成。这三种酶催化了从全反式视黄醇到11-顺式视网膜的三步反应:通过添加一个aycl基团(LRAT)将视黄醇酯化,利用酯水解(RPE65)的能量将视黄醇重新异构化到11-顺式视网膜(RDH5)。反应被CRALBP(细胞视网膜醛结合蛋白)加速,CRALBP也是酶复合体的一部分,11-顺式视网膜立即转移到CRALBP上。11-cis视网膜从CRALBP被释放到IRBP并被运送回光感受器。全反式视黄醇进入RPE和11-顺式视网膜离开RPE的确切机制尚不清楚。
视觉周期完成了维持视觉功能的基本任务,因此需要适应不同的视觉需求,如在黑暗或光明中的视觉[1,79]。为此,功能方面发挥了作用:视网膜的存储和反应速度的适应。基本上,在低光强度下的视觉需要较低的视觉周期翻转率,而在光下的翻转率要高得多。在突然从黑暗到光明的转变中,需要大量的11-cis视网膜。这不是直接来自视觉周期,而是来自几个视网膜结合蛋白池,它们通过视觉周期的运输和反应步骤相互连接。第一个池是11顺式视网膜在视杆外节段。当这个池的水平降低时,视网膜从下一个池(视网膜下空间的IRBP)摄取视网膜,开始重新填充这个池。该池视网膜水平的下降由CRALBP补充,CRALBP可由RPE65补充。11-cis视网膜的连接池可以迅速适应照明的变化。因此,RPE在视觉功能和光线适应方面起着至关重要的作用。 RPE65 plays a double crucial role in the visual cycle [83, 84]. On one hand it catalyses the re-isomerization reaction at light conditions. In the dark it function as retinol binding protein and represents an important retinol pool for the visual cycle. RPE65 combines both essential functions for adaptation of the visual cycle: storage and enzyme reaction.
6.光感受器外膜的吞噬作用
如前所述,由于光氧化损伤,光敏光感受器外节(POS)不断遭到破坏。为了维持视力,视网膜色素上皮通过脱落被破坏的顶端和吞噬视网膜色素上皮来不断更新角膜角膜[3,4,85 -89]。这是一个每日调节的过程,发生在早晨,由光触发[86- 88,90 -93]。光感受器外段的整个长度更新大约需要11天。夜间活动或白天活动的动物吞噬的昼夜节律相同[94]。在这一过程中,光感受器外段的适当长度通过吞噬和POS脱落的协调活动来维持。这一过程不仅受昼夜节律的调控,还受RPE与光感受器之间的协调作用。
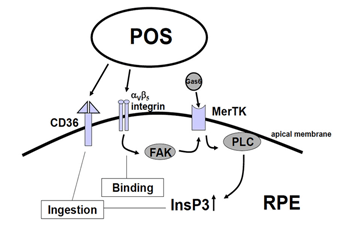
图6。吞噬作用。图中显示了参与光感受器外段吞噬起始的分子。起始始于光感受器外段膜的结合。结合事件被转导成细胞内信号,即细胞内InsP3的上升,这反过来导致摄入结合的光感受器外段膜。结合可能由整合素介导,信号转导通过受体酪氨酸激酶MerTK发生。摄食涉及巨噬细胞受体CD36。协同信号转导通过整合素和MerTK的相互作用通过局部粘附激酶发生。缩写:CD36,巨噬细胞吞噬受体;FAK,局部粘附激酶; Gas6, Growth-arrest-specific protein 6; InsP3, inositol-1,4,5-trisphosphate; MerTK, receptor tyrosine kinase c-mer; PLC, phospholipase C; POS, photoreceptor outer segment. (From Strauss, 2005 [2]).
主要有三个受体被确认参与了RPE对POS的吞噬调节(图6,上图):CD36,受体酪氨酸激酶c-mer (MerTK)和αVβ5整合素[95 - 102]。基本上,POS内化过程需要CD36,激活吞噬和α需要MerTKVβ5整合素是与POS结合和在白天状态下启动吞噬所必需的。这些受体之间的相互作用确保了调节和协调的POS吞噬。这些受体分子在细胞膜上的相关性在不同敲除动物的表型中被揭示。失去MerTk会导致人类视网膜色素变性和皇家外科学院(RCS)大鼠中类似类型的视网膜退行性变,这是最古老的遗传性视网膜退行性变动物模型[100-102]。β5整合素的丢失导致吞噬的昼夜调节的丧失,导致RPE中脂褐素积累的晚发[97-99]。
目前还不清楚是什么信号分子使RPE在吞噬开始时与光感受器进行通信。可能脱落POS的存在足以启动吞噬作用[103]。这一过程的第一步是POS通过αVβ5整合素与RPE结合。分泌的糖蛋白乳脂球- egf8 (MFG-8)由RPE表达,可激活αVβ5整合素,似乎是吞噬作用日刺激的重要激活因子[104-106]。整合素的激活会产生细胞内信号级联,其中包括局部粘附激酶(FAK)[98]。FAK能够磷酸化MerTK, MerTK现在可以被激活。MerTK的激活机制尚不清楚。MerTK的天然配体是一种叫做Gas6(生长抑制特异性蛋白6)的蛋白质。Gas6存在于视网膜中,并在RPE中强烈表达[107]。因此,Gas6可能是RPE吞噬作用的自分泌刺激物。
然而,最近的一篇文章认为,可能是MerTk的另一种配体在发挥作用。在这篇文章中,发现了在光感受器中发现的球形和球形样蛋白,可以与MerTK结合,代表RPE细胞吞噬过程中的“吃我”信号(也包括巨噬细胞)[108]。MerTK的激活导致细胞内信号级联,包括肌醇-1,4,5-三磷酸(InsP3)的产生和随后细胞内游离钙的增加2 +.吞噬作用是由吞噬受体CD36实现的。
7.分泌
RPE是一种上皮细胞,它与一侧的感光细胞密切相互作用,但也必须能够与上皮细胞的血液一侧的细胞相互作用,如内皮细胞或免疫系统的细胞。为了与邻近组织进行交流,RPE能够分泌大量的因子和信号分子。它分泌ATP、fas-L、成纤维细胞生长因子(FGF-1、FGF-2和FGF-5)、转化生长因子-β (TGF-β)、胰岛素样生长因子-1 (IGF-1)、纤毛神经营养因子(CNTF)、血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)、晶状体上皮衍生生长因子(LEDGF)、白细胞介素家族成员、基质金属蛋白酶组织抑制剂(TIMP)和色素上皮衍生因子(PEDF)[2]。
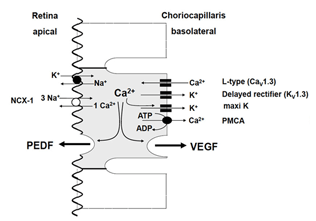
在健康的眼睛中,这些因素中的一些会不断被释放出来,帮助维持邻近组织的结构完整性。例如,PEDF是一种神经营养因子,它被分泌到RPE的根尖/视网膜侧,通过防止细胞凋亡来稳定神经元视网膜[109-111]。VEGF和TIMP分泌到RPE的基底外侧,是稳定脉络膜内皮的开窗结构所必需的[112]。当视网膜或RPE暴露在病理条件下,如缺氧或代谢应激时,其他因素被激活。在健康和疾病中,为了使RPE的分泌活动得到良好的调控,RPE表达了大量的Ca2 +-依赖的调节机制[113](图7和图8)。如果在某些病理条件下分泌调节失效,则RPE将促进增生性疾病,如脉络膜新生血管。
图7。在健康的眼睛中,RPE将神经营养因子PEDF分泌到RPE顶端侧的视网膜下间隙。血管生成因子,VEGF从基底外侧分泌到细胞外基质,在那里它稳定绒毛膜的内皮并帮助保持它的开窗。RPE细胞表达l型钙的神经内分泌亚型2 +频道。激活这些通道增加细胞内游离钙2 +从而引发生长因子的释放。通过激活延迟整流器K来终止l型通道的失活+细胞通道和超极化或通过运输机制减少细胞内游离钙2 +如Ca2 +腺苷三磷酸酶或Na+/ Ca2 +换热器。延迟整流器(KV1.3),外延迟整流K+由K组成的通道V1.3单元;l型(CaV1.3), l型2 +由Ca定义的神经肾上腺素亚型的通道V1.3或α1D亚基;最大k,大电导Ca2 +端依赖K+通道;NCX-1,心脏钠钙交换物-1;PEDF:色素上皮衍生因子;PMCA:质膜钙- atp酶;血管内皮生长因子。(从施特劳斯2005[2])。
RPE分泌活性的主要触发因素是细胞内游离钙的增加2 +第二信使。为了调节不同因子的特异性分泌,RPE表达大量不同的离子通道或转运蛋白,增加细胞内游离钙2 +.就像在许多其他的分泌组织,如胰腺的-细胞或神经内分泌细胞,RPE表达电压依赖性钙2 +神经内分泌亚型的通道。后者由Ca组成V1.3亚型(114 - 116)。在RPE中,l型通道由胞质酪氨酸激酶(如src型激酶)或受体酪氨酸激酶(如FGF受体FGFR-2)调控[117-119]。由于已知大量因素通过酪氨酸激酶作用来增加RPE的分泌,l型通道调节不同因素的数量。
另一个Ca2 +TRPV2通道(瞬时受体-电位通道,香草素亚型)被认为参与RPE调节生长因子分泌[120]。该通道的激活导致RPE增加VEGF的分泌。似乎IGF-1刺激的VEGF主要是通过TRPV2激活的信号级联而增加的。这个离子通道是理解一些临床观察的一个有趣的候选者。TRPV2通道可以通过加热激活。热依赖性激活TRPV2通道可刺激VEGF的分泌。激光治疗导致RPE的温度升高,常用于治疗变性如AMD或糖尿病视网膜病变。同样的激光治疗最有可能导致RPE生长因子的分泌增加,这可能是TRPV2的激活允许这种分泌。
8.眼睛的免疫特权
内眼是免疫特权空间,与血流的免疫系统分离[121-123]。RPE以两种方式支持免疫特权。首先,它代表了一种机械的、紧密的屏障,将眼睛内部空间与血流隔开。其次,RPE能够与免疫系统通信,以抑制健康眼睛的免疫反应,或在疾病情况下激活免疫系统(图8)。为此,RPE可以分泌免疫调节因子,如白细胞介素-8 (IL-8)[124]、补体因子H (CFH)[125, 126]或单核细胞趋化蛋白-1 (MCP1)[127]。RPE能够通过表达相应的受体对免疫信号级联的不同因子产生反应。这些受体是MHC受体[128,129]、toll样受体[130]或肿瘤坏死因子-α (TNF-α)等信号分子的受体[131]。
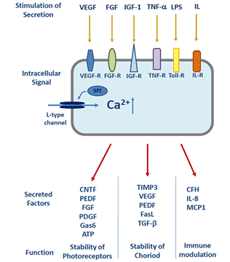
图8。RPE中的生长因子信号。RPE对分泌的刺激和分泌分子的功能作用的总结。分泌的诱因是钙2 +- RPE的通道。缩写:ATP,三磷酸腺苷;CFH,补体因子H;CNTF:睫状神经营养因子;FASL、CD95凋亡受体配体;FGF,成纤维细胞生长因子;IL,白介素;IGF-1,胰岛素样生长因子-1;有限合伙人,脂多糖;PEDF:色素上皮衍生因子; PDGF, platelet-derived growth factor; TIMP3, tissue inhibitor of metallo matrix proteases; VEGF, vascular endothelial growth factor; TGF-β, transforming growth factor-β. Receptors: FGF-R, fibroblast growth factor receptor; IGF-R, insulin-like growth factor receptor; IL-R, interleukin receptor; MCP-1, monocyte chemotactic protein 1; TNF-R, tumor necrosis factor receptor; Toll-R, toll-like receptors; VEGF-R, vascular endothelial growrc, src-type intracellular tyrosine kinase. (Adapted from Strauss, 2009 [133]).
RPE能够与免疫系统相互作用的知识最近引起了越来越多的兴趣。许多类型的视网膜退行性变似乎与免疫反应抑制不足有关,例如,年龄相关性黄斑退行性变(参见Hageman et al. webvision章节)。另一方面,了解RPE的免疫特权将有助于通过注射多肽、病毒基因疗法或移植方法治疗视网膜变性。
9.参考文献
1.Lamb TD, Collin SP, Pugh EN, Jr.(2007)脊椎动物眼睛的进化:视蛋白,光感受器,视网膜和眼杯。神经科学:960-76
2.视网膜色素上皮在视觉功能中的作用。杂志85:845牧师- 81
3.视网膜色素上皮细胞:视力的多功能伙伴。细胞科学杂志17:189-95
4.Steinberg RH(1985)视网膜色素上皮和神经视网膜之间的相互作用。医生角膜切削60:327-46
5.Sparrow JR, Hicks D, Hamel CP(2010)视网膜色素上皮在健康和疾病中的作用。Curr Mol Med:802-23
7.Rizzolo LJ(1997)极性与外血视网膜屏障的发展。Histol Histopathol 12:1057 - 67
8.Fessler F (1920) Zur Entwicklungsmechanik des Auges。机械拱46:19 9-201
9.McCaffery P, Lee, M., Wagner, M. E, Sladek, N. E, DrŠger, u.c.(1992)视网膜背前腹轴的不对称视黄酸合成。发展115:371 - 382
12.Hollyfield JG(1999)透明质酸与光间受体基质的功能组织。投资眼科视觉科学40:2767-9
14.Uehara F, Matthes MT, Yasumura D, LaVail MM(1990)光诱发的光间受体基质的变化。科学248:1633-6
15.Guymer R, Luthert P, Bird A (1999) Bruch膜及其相关结构随年龄的变化。Prog Retin Eye Res 18:59-90
16.Beatty S, Koh H, Phil M, Henson D, Boulton M(2000)氧化应激在年龄相关性黄斑变性发病机制中的作用。Surv角膜切削45:115-34
17.比蒂S, Boulton M, Henson D, Koh HH, Murray IJ(1999)黄斑色素与年龄相关性黄斑变性。Br J Ophthalmol 83:867-77
18.Winkler BS, Boulton ME, Gottsch JD, Sternberg P(1999)氧化损伤与年龄相关性黄斑变性。摩尔Vis 32
19.Alm A, Bill A(1970)正常和高眼压下猫葡萄膜的血流和氧气提取。物理学报80:19-28
20.Alm A, Bill A(1972)视网膜的氧气供应。一、眼内血压、动脉血压、动脉P O2、P CO2变化对猫玻璃体氧张力的影响。物理学报84:261-74
21.Alm A, Bill A(1972)视网膜的氧气供应。2高眼压和动脉二氧化碳张力增加对猫葡萄膜和视网膜血流的影响。放射性标记微球的研究,包括大脑和其他一些组织的流量测定。物理学报84:306-19
22.Alm A, Bill A(1973)猴子眼压正常和眼压升高时的眼和视神经血流(猕猴病毒):一项用放射性标记微球进行的研究,包括在大脑和其他一些组织中的血流测定。经验眼Res 15:15-29
23.黄文华,王文华,王文华(2002),脉络膜血流量。一、眼组织温度作为血流测量。角膜切削100:1323-6
24.Parver LM(1991)脉络膜血流的温度调节作用。眼(Lond) 5 (Pt 2):181-5
25.Boulton M, dayhawa - barker, P.(2001)视网膜色素上皮的作用:地形变化和衰老变化。眼睛15:384 - 389
26.视网膜色素上皮细胞的老化。在:Osborne NN, Chader GJ(编)视网膜研究进展。佩加蒙出版社,牛津纽约,125-51页
27.Schutt F, Davies S, Kopitz J, Holz FG, Boulton ME(2000)脂褐素的类视黄酮成分A2-E对人RPE细胞的光损伤。投资眼科视觉科学41:2303-8
29.Delori FC, Goger DG, Dorey CK(2001)正常受试者RPE中脂褐素的年龄相关积累和空间分布。投资眼科视觉科学42:1855-66
30.Miller SS, Steinberg RH(1977)青蛙视网膜色素上皮细胞离子的主动转运。Exp Eye Res 25:35 -48
31.Miller SS, Steinberg RH(1977)青蛙视网膜色素上皮的被动离子性质。生物医学杂志36:337-72
32.Ban Y, Rizzolo LJ(2000)视网膜色素上皮发育过程中葡萄糖转运蛋白的调控。Dev Brain Res 121:89-95
36.Hughes BA, Gallemore RP, Miller SS(1998)视网膜色素上皮细胞的转运机制。在:Marmor MF, Wolfensberger TJ (eds)视网膜色素上皮。牛津大学出版社,纽约,牛津,103-134页
37.Hamann S(2002)眼内水分运输的分子机制。Int Rev Cytol 215:395-431
38.Adler AJ, Southwick RE(1992)光感受器基质中葡萄糖和乳酸的分布。眼科Res 24:243-52
39.埃德尔曼JL,米勒SS(1991)肾上腺素刺激液体在牛视网膜色素上皮细胞的吸收。眼科杂志32:3033-40
40.Hughes BA, Miller SS, Machen TE(1984)环AMP对青蛙视网膜色素上皮细胞液体吸收和离子运输的影响。开路状态下的测量。J Gen physics 83:875-99
41.Tsuboi S(1987)测量狗视网膜色素上皮的体积流量和水力传导率。眼科科学28:176 -82
42.高平(1996)+分离的人视网膜色素上皮细胞中的电流。投资眼科可视科学37:1125-39
43.胡建刚,Gallemore RP, Bok D, Lee AY, Frambach DA (1994) NaK atp酶在培养的人视网膜色素上皮上的定位。投资眼科视觉科学35:3582-8
44.Frambach DA, Roy CE, Valentine JL, Weiter JJ(1989)早产儿视网膜粘连受速尿和瓦巴因的影响。Curr Eye Res 8:553-6
45.Miller SS, Edelman JL(1990)牛视网膜色素上皮中的活性离子转运途径。杂志424:283 - 300
46.Joseph DP, Miller SS(1991)牛视网膜色素上皮顶端和基底膜离子转运机制。杂志435:439 - 63
47.Cl-在青蛙视网膜色素上皮细胞中的转运。经验眼Res 54:921-31
48.速尿对青蛙视网膜色素上皮细胞内氯活性的影响。Curr Eye Res 3:673-5
50.Blaug S, Quinn R, Quong J, Jalickee S, Miller SS(2003)视网膜色素上皮功能:CFTR的作用?医生角膜切削106:43-50
52.张丽娟,张丽娟,张丽娟(2008)bestrophin的分子生理学研究:与最佳疾病和其他视网膜病变相关的多功能膜蛋白。杂志88:639牧师- 72
53.王晓燕,王晓燕,王晓燕(2003)+,乳酸和水在猪视网膜色素上皮细胞。经验眼Res 76:1-12
54.Keller SK, Jentsch TJ, Janicke I, Wiederholt M(1988)培养的牛视网膜色素上皮细胞内pH的调节。弗鲁格拱411:47-52
55.李晓东,李晓东,李晓东(1986)pH和K的相互作用+培养牛视网膜色素上皮细胞的电导。Am J Physiol 250:C124-37
56.la Cour M(1991)青蛙视网膜中的pH稳态:钠的作用+:HCO3-在视网膜色素上皮中的共转运。眼科学学报(哥本哈根)69:496-504
57.la Cour M, Lin H, Kenyon E, Miller SS(1994)新鲜分离的人胎儿视网膜色素上皮乳酸转运。投资眼科视觉科学35:434-42
58.米勒(1994)+牛色素上皮中的Cl-转运机制可能调节视网膜下空间的体积和组成。杂志475:401-17
59.Botchkin LM, Matthews G(1993)视网膜色素上皮细胞肿胀激活的氯电流。Am J Physiol 265:C1037-45
60.Hamann S, la Cour M, Lui GM, Bundgaard M, Zeuthen T(2000)体外培养的人胎儿视网膜色素上皮细胞中质子和乳酸的转运。弗鲁格拱440:84 - 92
61.Wolfensberger TJ, Dmitriev AV, Govardovskii VI(1999)抑制膜结合碳酸酐酶降低视网膜下pH值和体积。医生角膜切削97:261 - 71
62.Linsenmeier RA, Padnick-Silver L(2000)正常和脱离视网膜中光感受器对脉络膜的代谢依赖性。投资眼科视觉科学41:3117-23
63.视网膜下液的控制:实验和临床研究。眼睛4:340 - 344
65.Stamer WD, Bok D, Hu J, Jaffe GJ, McKay BS(2003)人视网膜色素上皮水通道-1在上皮水运动中的作用。投资眼科视觉科学44:2803-8
66.Steinberg RH, Linsenmeier RA, Griff ER(1983)视网膜色素上皮细胞的三种光诱发反应。视觉Res 23:1315-23
67.Baylor D(1996)光子如何开始视觉。美国科学院学报93:560-5
68.视网膜色素上皮控制视网膜下间隙的钾活性。眼科学杂志173:9-10
69.志村明,袁毅,张婷婷,张松,Campochiaro PA, Zack DJ, Hughes BA (2001) K(+)通道Kir7.1在视网膜色素上皮。杂志531:329-46
70.Hughes BA, Takahira M (1998) atp依赖性内整流K+牛视网膜色素上皮细胞中的电流。Am J physics 275:C1372-83
71.la Cour M, Lund-Andersen H, Zeuthen T(1986)青蛙视网膜色素上皮的钾转运:视网膜下空间钾活性的自动调节。杂志375:461 - 79
72.黄斌,Karwoski CJ(1992)青蛙视网膜下空间体积的光诱发扩张。J > 12:4243-52
74.Lin H, Kenyon E, Miller SS(1992)人视网膜色素上皮中na依赖的pHi调节机制。投资眼科视觉科学33:3528-38
75.林辉,Miller SS(1991)青蛙视网膜色素上皮的pHi调节:两种顶端膜机制。是J物理261:C132-42
76.Okada T, Ernst OP, Palczewski K, Hofmann KP(2001)激活视紫红质:来自结构和生化研究的新见解。生物化学科学26:318-24
77.Hofmann KP(1999)光激活视紫红质的信号状态。诺华发现Symp 224:158-75;讨论175 - 80
78.Baylor DA, Burns ME(1998)视觉视紫红质活性的控制。眼12 (Pt 3b):521-5
79.Lamb TD, Pugh EN, Jr.(2004)黑暗适应与视觉的类视黄酮周期。Prog Retin Eye Res 23:307-80
80.吴淑敏,王晓燕,王晓燕,王晓燕,王晓燕(2003)视网膜疾病与视网膜类视黄酮周期的关系。Vis Res 43:2957 - 2958
81.Thompson DA, Gal, A.(2003)视网膜色素上皮细胞中的维生素A代谢:基因、突变和疾病。Retin Eye Res 22:683-703
82.Thompson DA, Gal A(2003)视网膜色素上皮细胞维生素A代谢的遗传缺陷。Dev角膜切削37:141-54
83.薛琳,Gollapalli DR, Maiti P, Jahng WJ, Rando RR(2004)视觉周期调节中的棕榈酰化开关机制。细胞117:761 - 71
84.Jin M, Li S, Moghrabi WN, Sun H, Travis GH (2005) Rpe65是牛视网膜色素上皮中的视黄酮异构酶。细胞122:449-59
86.LaVail MM(1976)与循环照明相关的杆外段圆盘脱落。Exp Eye Res 23:27 -80
87.大鼠棒外节盘脱落的昼夜节律性。投资眼科视觉科学19:407-11
88.LaVail MM(1983)视网膜外节盘脱落和吞噬作用。眼科医学杂志103 (Pt 4):397-404
89.Kevany BM, Palczewski K(2010)视网膜视杆和视锥感光细胞的吞噬作用。生理学(贝塞斯达)25:8-15
90.Green CB, Besharse JC(2004)视网膜生物钟和视网膜生理控制。《生物节律》19:91-102
91.Besharse JC, Defoe DM(1998)视网膜色素上皮在光感受器膜翻转中的作用。在:Marmor MF, Wolfensberger TJ (eds)视网膜色素上皮。牛津大学出版社,牛津,152-172页
92.Besharse JC, Hollyfield JG(1979)小鼠感光器外节在恒定光和暗条件下的周转。投资眼科视觉科学18:19 -24
93.Besharse JC, Hollyfield JG, Rayborn ME(1977)光感受器外节段:暴露于光后,感光棒的膜更新加速。科学196:536-8
94.Bobu C, Hicks D(2009)昼夜节律时钟和环境光照对哺乳动物视网膜光感受器吞噬的调节。投资眼科可视科学50:3495-502
95.Finnemann SC, Silverstein RL (2001) CD36和alphavbeta5整合素在视网膜色素上皮感光细胞吞噬中的不同作用。J实验医学194:1289-98
96.Ryeom SW, Sparrow JR, Silverstein RL (1996) CD36参与视网膜色素上皮细胞对棒外节段的吞噬。《细胞科学》109 (Pt 2):387-95
98.Finnemann SC(2003)局部粘附激酶信号通路促进整合素结合光受体的吞噬作用。Embo J 22:4143 - 4154
103.Teirstein PS, Goldman AI, O 'Brien PJ(1980)大鼠棒外节盘脱落的局部和中央调控证据。投资眼科视觉科学19:1268-73
107.卡尔·莫,克罗格W, Wimmers S, Milenkovic VM, Valtink M, Engelmann K, Strauss O(2008)内生气体6和钙2 +-通道激活调节视网膜色素上皮吞噬作用。手机信号20:1159 - 68
108.Caberoy NB, Zhou Y, Li W (2010) Tubby和Tubby -like protein 1是新的MerTK吞噬配体。EMBO J 29:3898 - 910
109.Cayouette M, Smith SB, Becerra SP, Gravel C(1999)色素上皮衍生因子延缓遗传性视网膜变性小鼠模型光感受器的死亡。一般人说6:523-32
110.王丽娟,王丽娟,王丽娟,王丽娟,王丽娟,王丽娟,王丽娟,王丽娟,王丽娟(2001)色素上皮衍生因子对视网膜缺血损伤的神经保护作用。Curr Eye Res 22:245-52
112.王晓东,王晓东,王晓东(2003)眼科疾病中血管内皮生长因子与血管生成的关系。Retin Eye Res 22:1-29
113.温默斯,卡尔·莫,施特劳斯O (2007) RPE中的离子通道。Prog Retin Eye Res 26:63 -301
114.罗森塔尔,施特劳斯(2002)2 +- RPE中的通道。Adv Exp Med bio 514:225-35
115.电压门控钙的结构和调节2 +频道。Annu Rev Cell Dev bio 16:521-55
116.(2)心脏l型钙的药理、结构和功能+)通道。细胞物理生物化学9:42 -69
122.马宁,吴德峰,吴德峰,张志伟(2002)神经视网膜和色素上皮移植的免疫生物学和优越性。视觉Res 42:487 - 95
123.视网膜色素上皮作为免疫特权组织功能的证据。投资眼科视觉科学41:3467-73
126.陈明,Forrester JV,徐红(2007)视网膜色素上皮细胞合成补体因子H被氧化的光感受器外节段下调。Exp眼Res 84:635-45
127.Austin BA, Liu B, Li Z, Nussenblatt RB(2009)生物活性纤维连接蛋白片段刺激小鼠视网膜色素上皮MCP-1和分解代谢细胞因子的释放。眼科科学50:2896-902
132.Thompson DA和Gal A.(2003)视网膜色素上皮细胞中的维生素A代谢:基因、突变和疾病。Prog Retin Eye Res 22: 683-703
133.Strauss, O(2009)视网膜色素上皮在视觉功能中的作用。Ophthalmologe 106: 299 - 304
奥拉夫施特劳斯他是柏林人,在柏林接受教育,1990年获得柏林自由大学的动物学和生理学博士学位,1999年获得柏林自由大学的康复学位。在汉堡大学实验眼科学担任了五年教授之后,他在雷根斯堡大学医院担任了一个实验眼科学的职位。他目前是雷根斯堡大学实验眼科学教授。他的研究兴趣一直是了解视网膜色素上皮的功能。RPE的两个主要研究领域是令人感兴趣的:分泌和吞噬。他的工作重点是离子通道和胞质Ca2+存储对Ca2+依赖的调节。最近的工作集中在Best 's黄斑营养不良中bestrophin-1与电压依赖性Ca2+通道的相互作用以及肾素-血管紧张素系统对视网膜功能的全系统影响。电子邮件地址:Olaf.Strauss@klinik.uni-regensburg.de