拉尔夫·纳尔逊和维多利亚·康诺顿
1.介绍。
视网膜神经节细胞通常距离视网膜感光细胞只有两个突触,但神经节细胞的反应远比感光细胞的反应多样化。光感受器到神经节细胞的最直接途径是通过视网膜双极细胞。因此,了解双极细胞如何转换视觉信号是很有意义的。
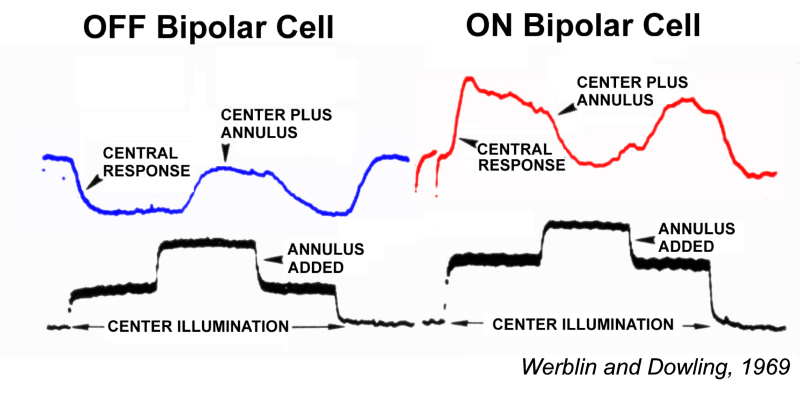
Werblin和Dowling(1)率先研究了视网膜双极细胞的光诱发反应。基于这些使用穿透微电极的研究,他们提出视网膜双极细胞缺乏脉冲活性,它们通过模拟信号的集成处理视觉信号,即突触电流和非峰值产生的电压门控膜电流。
Werblin和dowin还提出视网膜双极细胞有两种基本类型:ON-center和OFF-center(图1)。两种类型的视网膜双极细胞在其感受野中都显示了一个与中心相对的周围区域,类似于之前描述的神经节细胞感受野的经典的拮抗中心-周围组织(2)。神经节细胞感受野组织在beplay2012下载 .ON-center双极细胞被位于感受野中心的小点刺激去极化。偏离中心的双极细胞受到同样的刺激而超极化。这两种类型都是通过中心外的外周感受野的光刺激而重极化的(图1)。双极细胞的ON-OFF反应没有被遇到(1)。ON-OFF反应,即刺激开始和抵消时的兴奋,首先发生在无分泌细胞中,双极细胞的突触后神经元中。
维尔布林和道林对双极细胞生理学的描述在几十年里被证明是相当持久的。双相细胞不增加的概念在一些双相类型中发现了例外。金鱼暗色适应的Mb1(杆状双极细胞)产生光诱发的钙尖刺。这些尖刺起源于双极细胞轴突末端(3,4)。通过基因成像技术,这一发现已扩展到许多斑马鱼双极细胞类型的轴突末端。在这些研究中,双极末端用Ca进行转基因标记2 +报告蛋白SyGCaMP2与钙离子光诱导波动的关系2 +然后用2光子光度法测定。65%的终端产生峰值Ca2 +信号(4).在地鼠视网膜cb5b双极细胞型中Na+动作电位由光驱动。视网膜上的其他双极类型没有表现出峰值(5)。这些结果表明双极细胞负责的视觉信号编码明显多于之前的设想,轴突末端的峰值是积极参与的。双极细胞中的脉冲产生将在关于的小节中进一步讨论电压门控电流.
形态和连通性
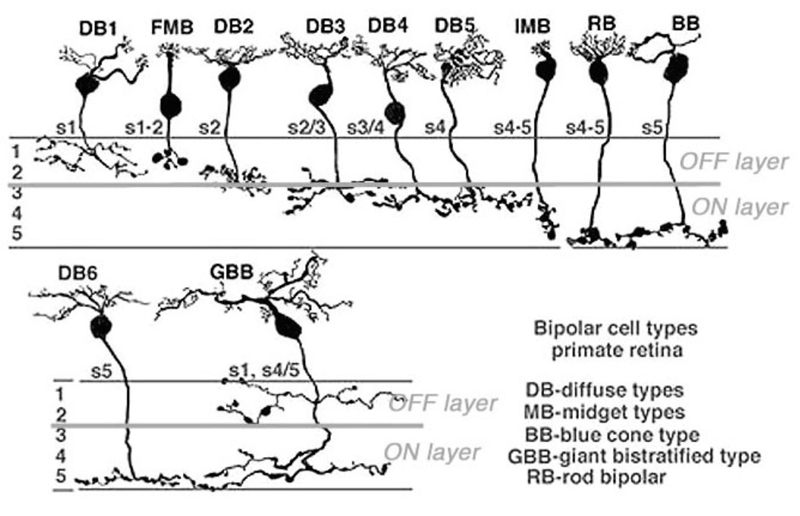
对双极细胞的解剖研究揭示了不同形态类型(6-12)的多样性(4-22),明显多于早期生理学所暗示的两种类型。人类视网膜双极类型的多样性如图2所示。尽管如此,所有这些都是ON或off类型,它们的多样性源于其他因素,如与光受体的不同连接和不同的突触后靶点,这在树突和轴突末端分支模式的多样性中得到了证明。一些双极细胞只对杆状细胞有突触后反应,另一些只对锥状细胞有突触后反应(图2),还有一些接受杆-锥混合输入。在锥选择性双极细胞中,有些只支配红色、绿色或蓝色的锥,而另一些是“弥漫的”,即没有选择性(13-19)。不同的双极型在与锥体的突触下接触处表达不同的谷氨酸受体。
双极性细胞的轴突末端可以是单层的,也可以是多层的,这取决于轴突钮扣和分支在内丛状层(IPL)中的位置。IPL中不同的末端位置和分支形态表明,不同的形态类型选择性地支配不同类型的无分泌细胞和神经节细胞(图2)。在灵长类动物视网膜中,双极细胞根据树突杆的范围被描述为弥漫性或侏儒型。侏儒只接触一个锥体,而扩散型接触多个锥体。双极细胞也被称为“扁平”或“内陷”(20),这取决于树突尖端的位置,或位于(扁平)表面,或穿透光感受器突触终末接近突触前带(内陷)。图2显示了高尔基染色视网膜中11种形态的双极细胞。
图2。人视网膜双极细胞类型的树突和轴突分层模式。插图由Helga Kolb提供。
双极性细胞的轴突末端可以是单层的,也可以是多层的,这取决于轴突钮扣和分支在内丛状层(IPL)中的位置。IPL中不同的末端位置和分支形态表明,不同的形态类型选择性地支配不同类型的无分泌细胞和神经节细胞(图2)。在灵长类动物视网膜中,双极细胞根据树突杆的范围被描述为弥漫性或侏儒型。侏儒只接触一个锥体,而扩散型接触多个锥体。双极细胞也被称为“扁平”或“内陷”(20),这取决于树突尖端的位置,或位于(扁平)表面,或穿透光感受器突触终末接近突触前带(内陷)。图2显示了高尔基染色视网膜中11种形态的双极细胞。
2.ON和OFF双极细胞的谷氨酸受体类型不同。
双极细胞的光反应是由与光感受器的突触启动的。光感受器只释放一种神经递质——谷氨酸(21);然而双极细胞对这种刺激有两种不同的反应,on中心(谷氨酸超极化)和off中心(谷氨酸去极化)。不同的突触后谷氨酸受体蛋白介导这些不同的膜极化机制。谷氨酸门控反应的不同与电离性(iGluR)谷氨酸受体(OFF双极细胞)、代谢性(mGluR)谷氨酸受体类型(ON双极细胞)或谷氨酸转运体(ON双极细胞)的差异表达有关。因此,光感受器到双极突触的信号转导具有一系列的特性。将图像分割成多个可选择性视觉特征的成分的过程始于不同感光细胞类型的分化,但随后在感光细胞和双极细胞之间的突触上进行了详细阐述。
ON双极细胞的代谢反应:mGluR6, Go、TRPM1 Nyctalopin
ON双极细胞的电导在光下增加,而OFF双极细胞的电导则降低(22,23)。OFF双极细胞电导的下降很容易解释为谷氨酸激发的丧失,因为光抑制了光感受器释放谷氨酸(24)。ON双极细胞光响应的正反转电位,加上电导的增加(22,25),意味着谷氨酸阻断了阳离子渗透通道。最初是一个谜,这是我们现在理解的代谢性谷氨酸受体(mGluRs)作用的第一个证据。这些受体本身并不形成离子通道,而是作为细胞表面的孤立天线,感知谷氨酸并激活细胞内通路,最终通过与谷氨酸结合位点相隔几步的机制影响膜电位。在光感受器(26)和双极细胞(27)的轴突末端已经发现了代谢受体,它们作为调节谷氨酸释放的自我受体。然而,在ON双极细胞树突的亚突触膜上的一种特异性mGluR的表达,即APB受体,是视网膜所特有的,它在光感受器到ON双极细胞的直接信号传递通路中起作用。
mGluR6受体
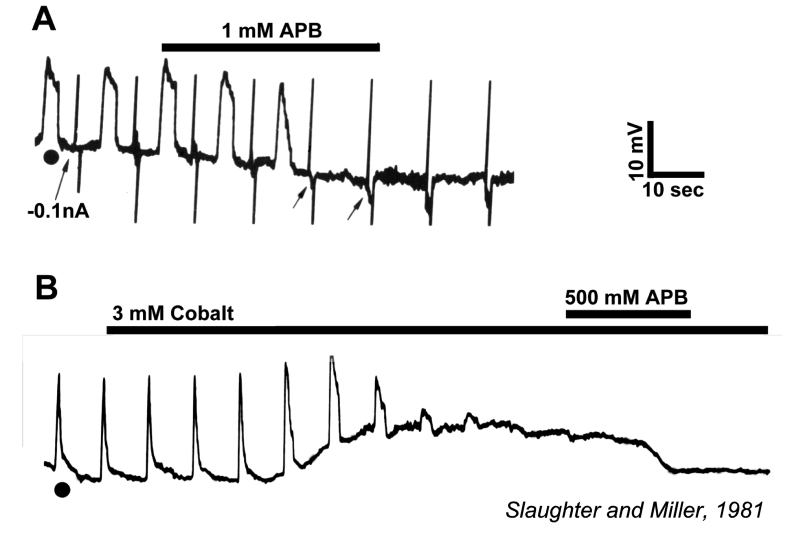
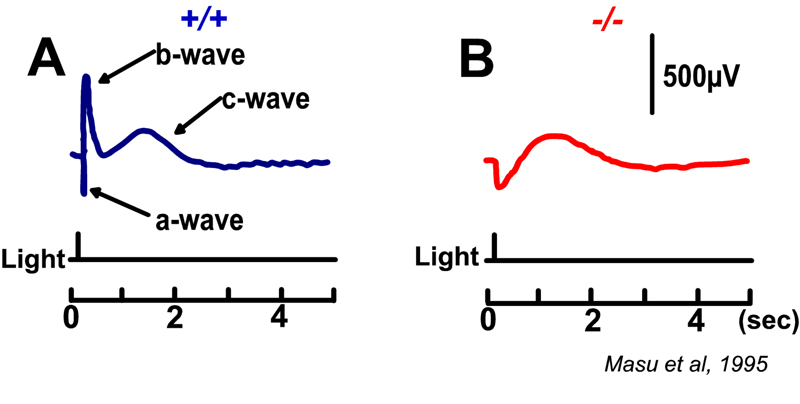
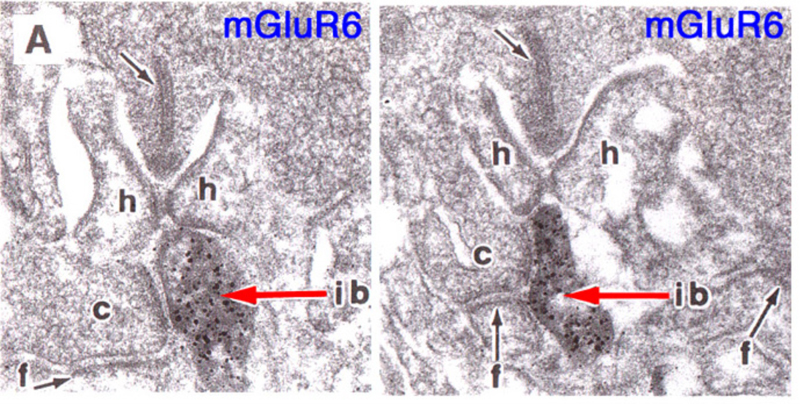
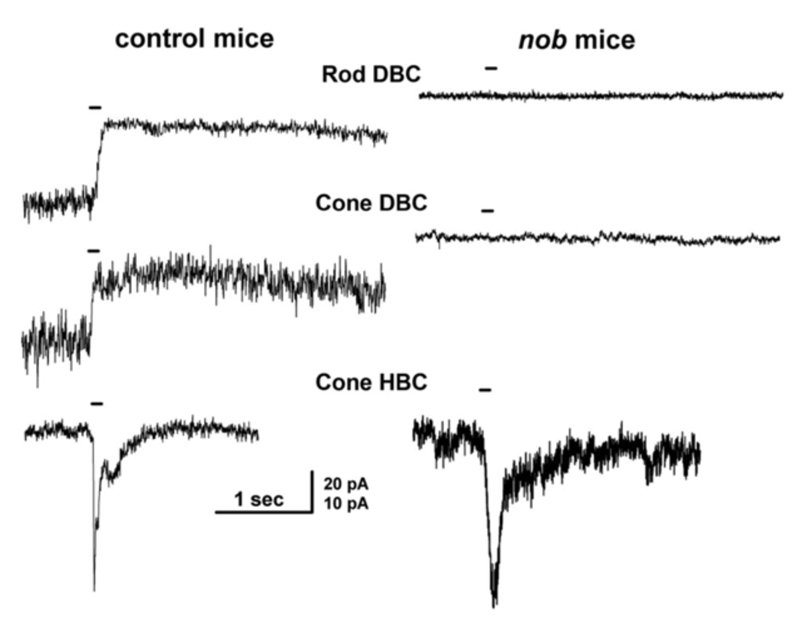
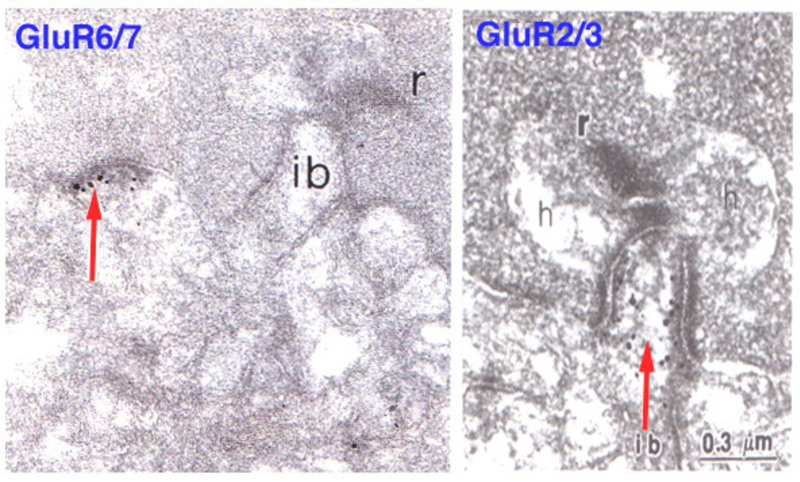
Slaughter和Miller(28)首次观察到代谢性谷氨酸激动剂2-氨基-4-膦丁酸(APB或DL-AP4, L对映体有效)完全阻断ON双极细胞的光反应。在这些神经元中,APB作为光受体释放谷氨酸的替代品(图3AB)。因此,ON双极细胞利用代谢途径来感知光感受器谷氨酸释放的光诱导变化。代谢受体被鉴定为mGluR6(29,30)。缺乏mGluR6基因的转基因敲除小鼠缺乏视网膜电图b波(图4AB), b波是一种与ON双极活性相关的诱发电位成分(31)。视网膜电图成分与细胞电生理的关系在Webvision章节中进一步讨论。网膜电图:ERG”。mGluR6的免疫细胞化学定位显示猴子双极细胞内陷树突尖染色(图5)(32)。在灵长类动物的视网膜中,内陷双极细胞被认为主要是ON型的。一些中心凹扁平触点也为mGluR6染色(32)。
蛋白Go
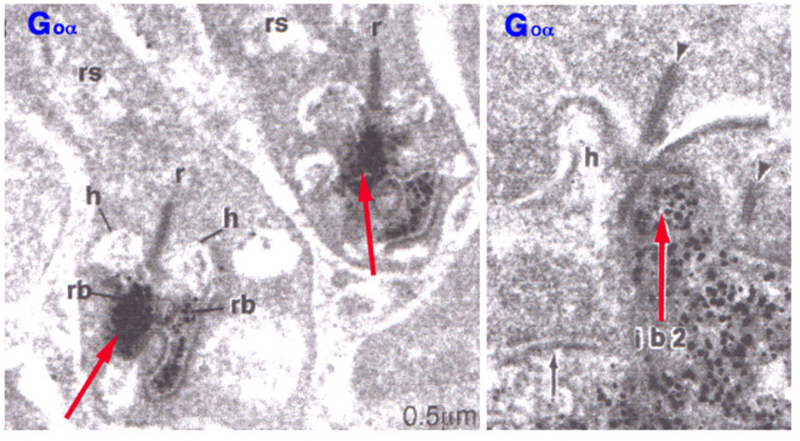
除了mGluR6, G蛋白Go胞质定位于ON双极细胞的树突状顶端(图6)(33)。α亚基(Gαo)敲除导致b波损失(34),类似于mGluR6敲除。Go最初定位于杆状双极细胞,已知为on型,在代谢光反应的潜在g蛋白第二信使筛选中(35)。这表明Go直接参与mGluR6激活后的细胞内通路。
与APB受体偶联的离子通道最初被认为是由cgmp调节的(36)。APB与mGluR6结合后离子通道的关闭似乎需要GTP和磷酸二酯酶,这与光转导类似(36)。然而,这发生的确切级联并不清楚,因为阻断磷酸二酯酶(PDE)活性,或添加不可水解的cGMP类似物,都不能抑制通过apb受体产生的谷氨酸反应(37)。此外,它是Go抑制ON双极细胞中的谷氨酸门控电流,而不是转导光转导级联的g蛋白(37)。因此,通道关闭似乎不需要去除cGMP(37)。
图6。疣状为Gαo是G蛋白G的α亚基o,定位于猫视网膜中一个杆状双极细胞(左)和一个锥体双极细胞(右)的内陷树突尖端。Gαo是光激活ON双极细胞所必需的。插图来自Vardi, 1998(33)。
TRPM1通道
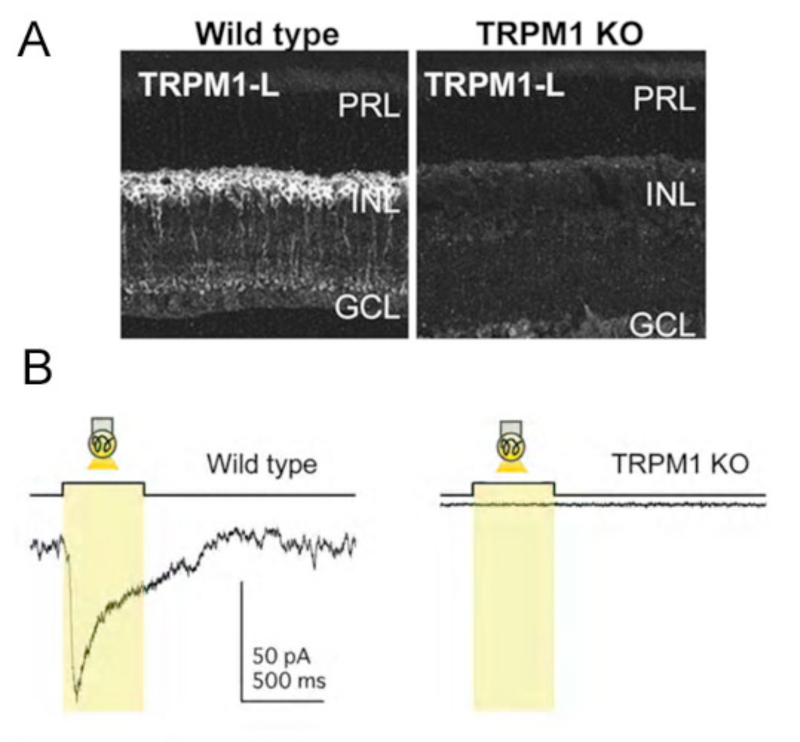
与这些发现一致的是,最近的研究表明mGluR6受体下游的on -双极细胞离子通道不是cgmp门控的(38)。相反,这种非选择性的阳离子通道——被识别为TRPM1-L通道——似乎受到Gα的调节o(38-40)结合Gβγ(41)。TRPM1通道的活性需要mGluR6的存在,因为该通道虽然存在,但在mGluR6敲除小鼠中不能被激活(42)。
TRP通道,或瞬时受体电位通道,首次在果蝇光感受器(43)存在于所有动物群体中,包括脊椎动物(44),并且已经确定了多达28个通道亚型。TRP超家族包括7个亚家族,分为两组:TRPC、TRPV、TRPM、TRPN和TRPA通道构成第1组;TRPP和TRPML通道组成第2组。TRPM1-L或melastatin是黑色素瘤相关的TRP通道,属于第1组,存在于ON双极细胞中。所有的通道都具有结构上的相似性,并且对阳离子具有渗透性;然而,不同的通道子类型之间有很大的功能多样性。色氨酸通道参与许多感觉系统,包括视觉、听觉、味觉、温度敏感性和渗透调节,也参与人类疾病(44-48)。
在视网膜上,光感受器(49)、无分泌细胞(50,51)和on型双极细胞上已发现TRP通道。具体来说,on -双极子(图7A)对TRPM1通道(52,53)或TRPM1- l(38,39,54)具有抗原性。采用免疫和/或原位杂交研究发现TRPM1在on -双极细胞的树突顶端有局部表达(38,39,52),尽管标记也在细胞体和轴突中可见(图7A)。off型双极细胞中没有色氨酸通道。TRPM1-L通道电流具有~0mV(38)的反转电位,类似于这些细胞中谷氨酸门控电流的反转电位。TRPM1-L已被证明与mGluR6共定位和/或功能耦合(38,40,42,52)。转染的CHO细胞表达mGluR6, Gαo和TRPM1-L、Koike及其同事(38)表明,这三种成分必须都存在,才能记录谷氨酸诱发的全细胞电流。只表达mGluR6和Gα的细胞啊,或者只GαoTRPM1-L对谷氨酸应用无反应(38,39)。这些发现表明TRPM1通道位于mGluR6受体的下游,是谷氨酸诱导这些细胞应答所必需的。此外,TRPM1 -/-敲除小鼠(图7B)没有光诱发的on -双极细胞反应,也没有ERG b波(38,39,55)。反应的丧失与报道的mGluR6 -/-小鼠类似(图4)(31,56),再次表明mGluR6和TRPM1通道都是on -双极细胞光反应所必需的。虽然所有的小鼠锥体双极细胞似乎都与锥体一起使用mGluR6突触,但有证据表明,除了TRPM1-L外,其中一些细胞可能还调节一个阳离子通道。在TRPM1 -/-小鼠中,mGluR6拮抗剂CPPG仍然阻断了轻微的apb诱导的膜电流(52)。
的蛋白多糖nyctalopin
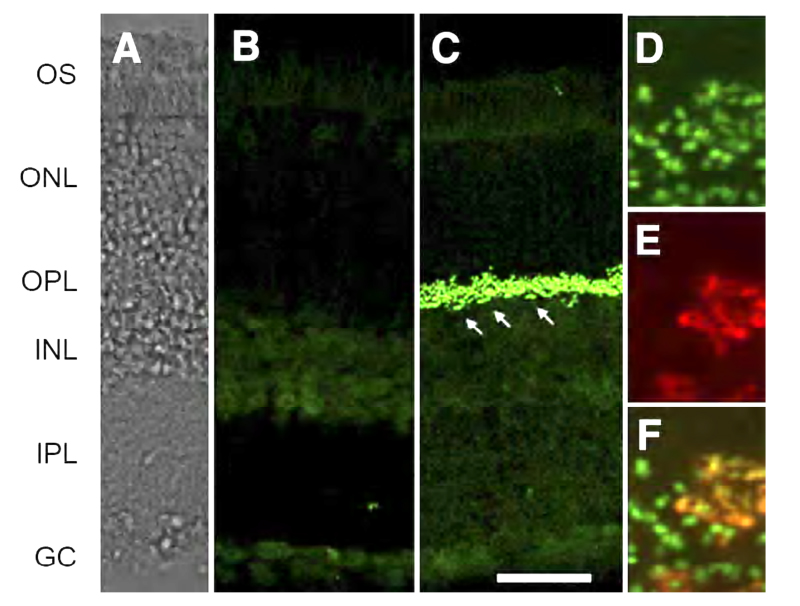
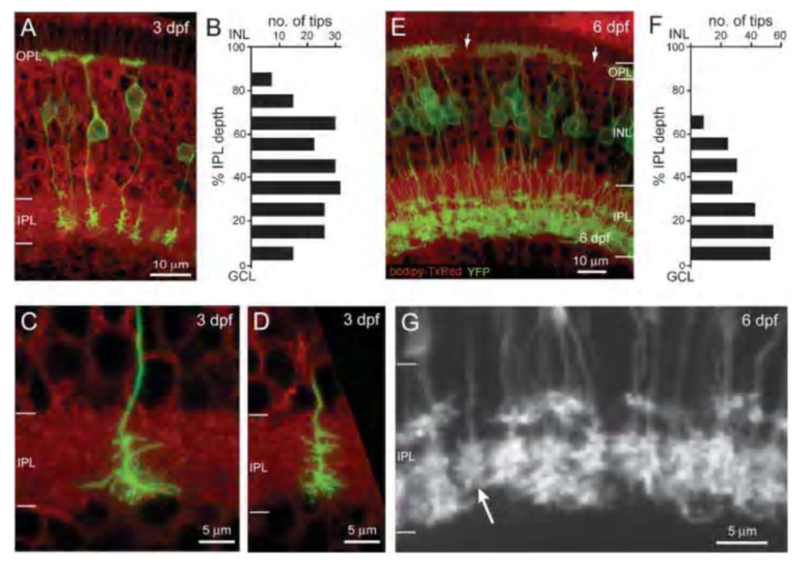
Nyctalopin是另一种在on -双极细胞树突尖上表达的蛋白(图8a)。编码尼克斯基因。尼克斯是ON双极细胞中光和谷氨酸诱导反应所必需的(57)。突变体头小鼠(58)缺乏ERG b波,对双极细胞树突上的谷氨酸局部应用无反应(57)。野生型小鼠的双极细胞对这种治疗反应为外向电流,但在头小鼠则没有(图9)头应变是一个尼克斯- / -突变(59)。代的转基因头在双极细胞中选择性表达EYFP-nyctalopin融合蛋白的小鼠完全挽救了突变表型。利用由双极细胞选择性产生的GABA受体亚基GABAcρ1的调控序列,细胞表达被限制在双极细胞中。EYFP -尼克斯线,融合蛋白表达定位于on -双极细胞尖端(图8a), b波恢复,视网膜内功能与对照组相似(57)。
在斑马鱼中,利用上游调控序列生成了一种膜靶向黄色荧光蛋白(MYFP)报告菌株尼克斯表达MYFP的基因。该报告标记了on型双极细胞的一个子集,具有特征性的长轴突和限于内丛状层内半部分的末端钮扣。其中许多也表达on -双极标记蛋白激酶C (PKC)(60)。这个基因报告显示了表达夜光蛋白基因的细胞的完整形态。该转基因工具被用于跟踪表达奈克托肽的双极子的胚胎细化和轴突投射模式的发展(60)(图8b)。
后续的研究报告称,在on -双极细胞中,尼可托肽复合物与mGluR6和TRPM1通道结合,发挥着允许受体和通道正确组装和组织的结构作用(61)。此外,nyctalopin能够调节TRPM1通道,mGluR6也是如此(42,62)。因此,谷氨酸结合在mGluR6上激活g蛋白(Gαo和/或Gβγ)导致TRPM1通道的关闭。受体和通道被奈克他洛平紧紧地控制在一起。这些成分- mGluR6,尼克斯托宾,TRPM1和/或Go-可导致on -双极细胞失去反应。与此一致的是,先天性静止性夜盲症(CSNB -在下面讨论)患者表现出on -双极细胞反应的丧失,这在ERG b波缺失中得到了证明,编码mGluR6、nyctalpin和TRPM1的基因突变至少与75%的CSNB病例相关(62)。
调节器和亚型
钙离子是ON双极代谢离子通道的调节剂。钙离子通过TRPM1离子通道(63,64)进入影响通道功能,要么直接下调通道(63),要么激活钙依赖酶,如CaMKII(65-67),调节离子通道电导。cGMP已被证明有选择性地增强ON双极细胞对昏暗光线的反应,并可能对TRPM1通道起调节作用(68)。
on -中心双极细胞的代谢受体有持续的和短暂的亚型(69)。其分子基础尚不清楚。然而,on -中心神经节细胞的持续和短暂反应,如经典的X型和y型(70),可能至少部分起源于支配它们的双极细胞上表达的谷氨酸受体类型(71)。
谷氨酸转运蛋白介导的ON双极细胞反应
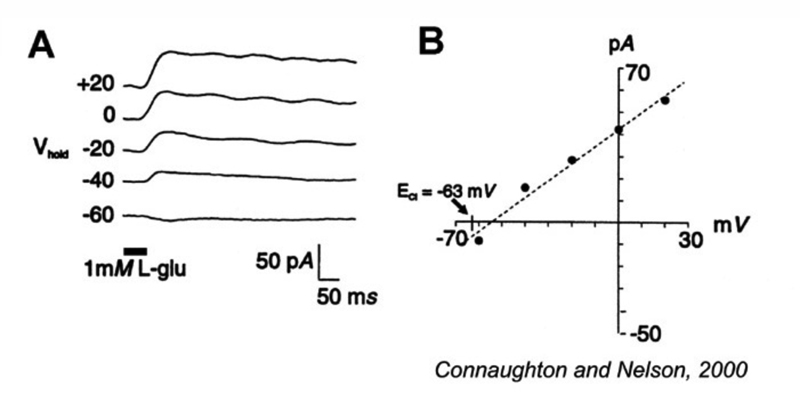
具有转运体样特性的离子化谷氨酸受体也存在于一些on中心的双极细胞树突上。当光感受器谷氨酸与这些转运蛋白结合时,即Cl−电导形成并使细胞在黑暗中超极化(图10)。从这个Cl中释放−光抑制发生在光感受器释放谷氨酸的减少。这使得双极细胞去极化(图10)。像转运蛋白一样,这个谷氨酸门控Cl−机制要求(Na+]o才能正常工作。到目前为止,这种机制仅在鲤类ON双极细胞中作为树突状谷氨酸‘受体’被发现(72-74),尽管在乌龟、蝾螈和老鼠的光感受器中也有报道(75-78),并且在哺乳动物中枢神经系统中也存在(79)。有趣的是,它发生在小鼠杆状和锥体双极细胞的轴突末端,通过抑制反馈调节谷氨酸释放(78)。
一些非哺乳动物双极细胞在树突上同时包含APB和促电离(转运体样)受体,而其他on细胞既表达促代谢性受体,也表达促电离受体,但不同时表达两者(72,73)。EAAT5已被确定为形成氯通道的谷氨酸转运蛋白(80)。嗜离子机制用于锥体细胞和双极细胞之间的持续传递(81,82),与代谢途径相比,它可能是一种快速的机制,代谢途径涉及多步细胞内通路,通常相对较慢(22)。
鱼的典型的Mb杆状双极细胞与杆状和锥状细胞都产生突触。当逆转电位正于静息电位时,杆状突触介导电导增加。锥体突触介导电导下降,反转电位负于静息电位(82)。这两种机制都提供on型光响应。回想起来,似乎杆状突触是代谢性的,而锥状突触是转运蛋白样的,这是同一神经元上的两种不同的、选择性定向的突触后谷氨酸机制。
安帕红氨酸受体在ON双极细胞中的表达
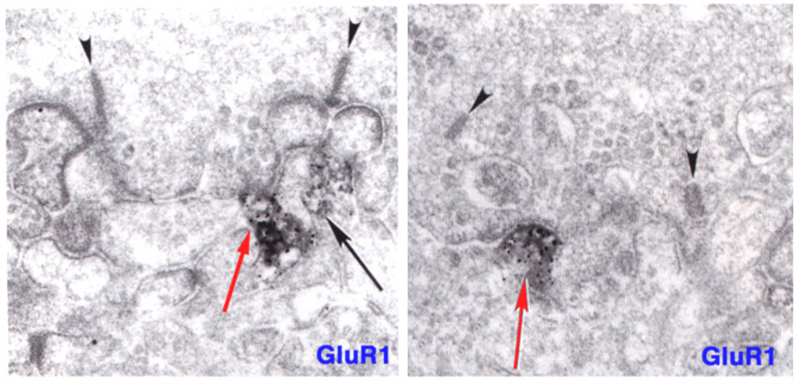
哺乳动物的on -中心双极细胞对电离性AMPA受体和代谢性mGluR6受体具有免疫活性(83-85)。在图11(右面板)中,猫体内内陷的on型色带接触处出现了GluR2/3(一种离子化AMPA亚基)的免疫反应性。同样,在硬骨鱼视网膜中,on中心双极细胞对电离性钾酸盐受体具有免疫活性(86,87)。特别是在哺乳动物中,这些传统的嗜离子受体通常与OFF双极细胞相关,但也在on中心双极细胞中可见,尚未发现其生理作用。在巨大的danio Wong和Dowling中发现双层锥体双极细胞混合了ON型和OFF型谷氨酸受体机制,并利用转运体样受体和AMPA/kainate受体分别对不同的光谱刺激产生ON和OFF颜色响应(88)。
OFF双极细胞的离子化谷氨酸反应
像ON双极细胞一样,OFF双极细胞表达多种谷氨酸受体,尽管它们都是电离性的。最初根据激动剂的选择性定义,有三种主要类型的离子化谷氨酸受体(AMPA, kainate和NMDA)。尽管免疫细胞化学研究(84,89,90)和原位杂交(91)已经在视网膜外发现了特定的NMDA受体亚基,但OFF双极细胞从未被观察到利用NMDA受体产生光反应。OFF双极细胞选择性表达AMPA或kainate受体(92,93)。在谷氨酸暴露后,这些受体以不同的速度敏感(图13),因此,强调光信号的不同时间特征。kainate型谷氨酸受体传递视觉刺激的持续特征。AMPA受体对信号的瞬态成分更具选择性(92)。在地鼠视网膜中,双极细胞对其中一种具有选择性(93)。这种情况很有趣,因为在中枢神经系统中,只使用红氨酸受体的神经元是罕见的。尽管如此,视网膜双极细胞上的AMPA和kainate受体在药理学上表现良好。 Bipolar-cell AMPA-type responses can be selectively suppressed by the lipophilic AMPA receptor antagonist GYKI 52466 (94). Conversely, bipolar-cell kainate-type responses are blocked by the desensitizing kainate receptor agonist SYM 2081 (95).
虽然所有视网膜都包含ON和OFF双极细胞通路,但很容易想象,在这些通路中,自然选择可能会导致树突谷氨酸受体类型的表达差异取决于物种的视觉需求。与这一假设一致的是,已经发现了ON和OFF双极细胞树突状谷氨酸反应的物种特异性差异。例如,具有转运蛋白样药理作用的离子化谷氨酸通道只发生在鱼视网膜的ON型双极细胞中。相反,在蝾螈中,OFF双极细胞只利用AMPA受体(96)。这可能也是斑马鱼视网膜的情况,分离细胞对蓝氨酸激动剂SYM 2081(86)没有反应,视网膜电OFF反应(d波)被AMPA拮抗剂GYKI 52466(97)阻断。人们可能还会认为,即使在AMPA和kainate受体的广泛类别中,子形式可能已经进化到适合特定的视觉利基。在蝾螈的视网膜中,确实存在不同种类的AMPA受体,它们位于视杆和视锥细胞的突触后(96,98)。
双极细胞轴突:内丛状层的ON和OFF层
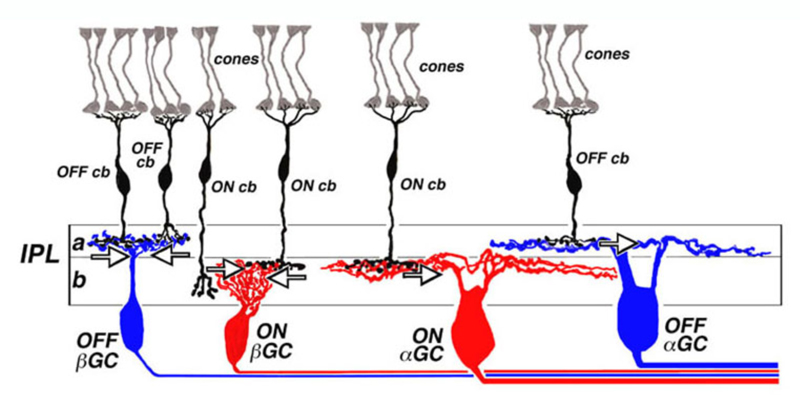
20世纪70年代中期在美国国立卫生研究院进行的研究(99,100)指出,猫视网膜神经节细胞的开或关特性与视网膜内丛状层内树突的分层水平有关。这导致了ON和OFF分层的一般方案,如图14所示。非中心神经节细胞的树突总是在上中心神经节细胞树突的远端乔木。离心树突状树化带称为亚层一个,而on中心的树枝状树化带称为亚层b(图14)。在每节神经节内,细胞与ON型或off型双极细胞选择性接触。双极细胞突触终端和神经节细胞树突的ON和OFF分层模式已被证明是所有脊椎动物视网膜的一致模式(101,102)。ON和OFF分层在神经节细胞类型以单层为主的视网膜中尤为明显。然而,在解剖结构更为复杂的视网膜中(如海龟),有多层和/或弥漫性分层的神经节细胞类型,ON / OFF分层模式只适用于单层细胞。具有整个IPL分支过程的细胞的生理学更难仅根据形态学来预测(103)。
锥体双极细胞轴突末端的分层
ON和OFF双极细胞的轴突末梢在不同的IPL层中分叉,它们分别是ON型和OFF型神经节细胞的突触前。off型接触锥体的双极细胞轴突末端的乔木化位于亚层一个,与off型神经节细胞的树突突触,on型锥体接触双极细胞的轴突末端树突位于亚层b,它们与on中心神经节细胞的树突接触。板下off型双极末梢与神经节细胞树突之间的突触一个和on型细胞b,已通过电子显微镜观察(104-109)。反应极性不匹配的双极细胞和神经节细胞之间的突触从未被观察到,即使是在反应过程非常接近的地方(105)。黑视素神经节细胞可能是这一规律的一个例外。小鼠和灵长类动物的外分层黑视素神经节细胞接受ON-cone双极细胞轴突的突触(110,111)。
Awatramani和Slaughter(69)提出了对两极细胞分层方案的进一步改进:具有强调视觉模式中瞬变的谷氨酸受体生理学的细胞向IPL的中心分层,而那些具有强调持续对比的谷氨酸受体模式的细胞向IPL的内外边缘分层。虽然以蝾螈视网膜为基础,但这种模式适合于猫视网膜的持续X (IPL内外边缘)和短暂Y型神经节细胞(IPL中央)的分层,以及灵长类视网膜的P和M细胞。Wu等人(11)在蝾螈中发现了类似的模式,但将其归因于其他电路元素的阐述,因为IPL中部有树突的双极细胞往往是锥主导的,强调速度和瞬态响应,而在IPL内外边缘有轴突末端分层的双极细胞处理杆信号,其波形相对更弱(11)。
ON或OFF双极细胞生理与轴突分层模式的穷尽相关性现在在一些物种中可用。光反应,或者作为光反应的替代物,树状谷氨酸反应或单个视锥细胞对电刺激的反应,都可以在视网膜切片的贴片微电极记录中测量。通过微电极染色,电生理结果与轴突和树突形态相关。
火蜥蜴
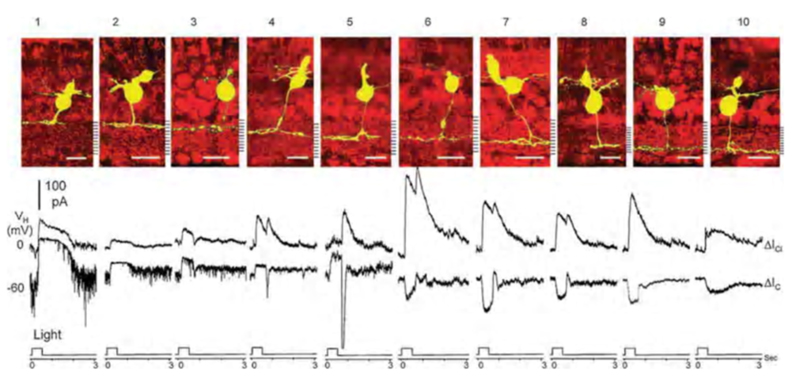
在蝾螈视网膜中,Pang、Gao和Wu(2004)(112)将双极细胞的光诱发反应分离为来自光感受器的谷氨酸能突触的阳离子电流和来自无分泌细胞的gaba能或甘氨酸能突触的氯电流。光诱发的阳离子电流的极性(ΔIC)与内丛状层的轴突分支水平有很好的相关性。蝾螈双极性细胞1-5型,内丛状层的外半部分轴突分层一个),都是OFF类型,向外输出ΔIC.6-10型,内丛状层内半部分轴突分层b),都是on型,向内提供ΔIC(图15)。通过在氯离子逆转电位(V米=−60 mV)。光诱发抑制性氯电流(ΔICl)通过在阳离子逆转电位(V米= 0 mV)。ON和OFF双极细胞都被氯电流抑制,很可能是由从无分泌细胞到双极细胞轴突末端的甘氨酸能和gaba能突触产生的。一种抑制模式为ON-持续,另一种为ON/OFF。除了轴突末端高度分层的双极细胞(图15),还遇到了其他分层更广泛甚至双层化的细胞,共有22种形态类型(12)。除a/b型在两个亚虫科均双层化外,其余均遵循ON-OFF分层规律。这些可以是ON或OFF,但通常双ON和OFF树突输入可以通过药理治疗进行解剖(112)。
Rod-dominated哺乳动物
在大鼠视网膜中,双极细胞轴突末端树形化似乎完全遵守ON和OFF分层的规则(7)。根据轴突分层水平判断,有9种双极类型。大鼠IPL外半区锥体双极细胞轴突1-5支一个).当这些细胞受到红氨酸(OFF双极细胞树突上的AMPA/红氨酸受体激动剂)的刺激时,会产生内向电流。在1-5型的15个记录中,只有一个细胞对APB (DL AP-4)有反应,APB是一种对ON中心双极细胞有选择性的谷氨酸激动剂。四种锥体双极细胞类型(6-9型),轴突在大鼠IPL的内半部分分支b)被确定。这些类型的14个细胞中有12个对APB有向外电流反应,而只有一个对红氨酸有反应(7)。这比大鼠视网膜锥体双极细胞轴突末梢的ON和OFF层序模式的一致性好90%以上。小鼠视网膜的双极细胞分支模式与大鼠相似(113)。在猫和猴子视网膜上的一组更有限的记录也表明,双极终极的ON和OFF层可能有很好的粘附性(109,114)。
地松鼠
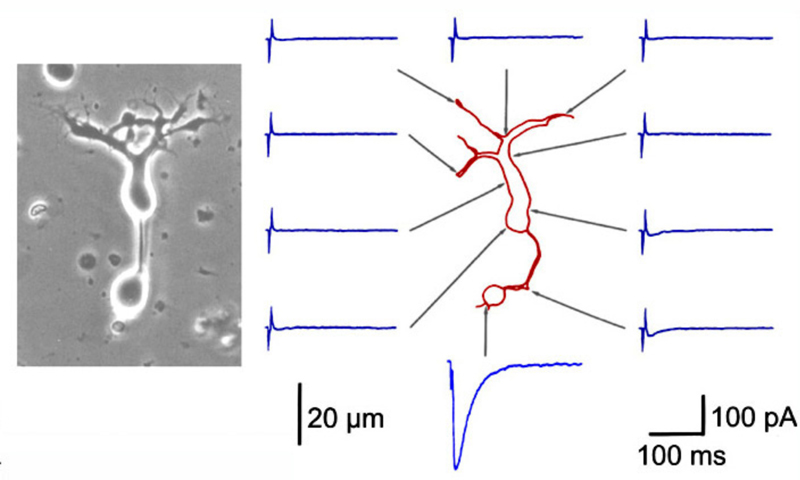
Li和DeVries(15)在地鼠全锥视网膜双极细胞的形态到功能的映射方面取得了重大的技术进展。在这些研究中,一个贴片电极被用于电刺激双极细胞树突杆内的单个锥体,同时被第二个微电极贴片和染色。用这种方法,锥接触和这些接触到双极细胞的性质是直接验证的。通过这种技术已经映射出六种锥体双极型,一种ON型只接触蓝色锥体,一种ON型和一种OFF型同时接触蓝色和绿色锥体,其余类型只接触绿色锥体(图16)。在地鼠双极细胞中未检测到使用不同谷氨酸受体的颜色对立锥突触输入。ON和OFF类型的层压模式遵循杆状支配的哺乳动物视网膜的层压模式(100,115)。
鲤科的
在解剖学研究中,Connaughton等人(2004)(6)使用一种称为“二元标记”的技术,根据轴突分层模式区分了斑马鱼的17种两极细胞类型。在Dowling实验室仍在进行的工作中,锥体接触模式被添加到轴突分层模式中(116,117),从而产生了大约20种或更多的可以在解剖学上区分的双极类型。然而,在后一项研究中,90%的例子都是由这类类型中的9种造成的。有5个完全与锥体接触的类群,以锥体接触的模式和轴突分层来区分。除了各种锥组(Mb类型)外,还有4种接触棒。最具选择性的球果接触型只接触绿球果。它在树枝状和轴突场中非常宽,并且是off -分层的。光感受器接触最扩散的模式是OFF分层类型,它接触所有的光感受器,杆,红,蓝,绿和UV锥。在哺乳动物中,从单个双极细胞发出的所有树突接触似乎都表达相同的谷氨酸受体(15)。但在鱼类或两栖类双极细胞中似乎不是这样,在这些细胞中,同一个细胞可能在不同的树突尖端表达不同的谷氨酸受体(72,82,88,112),每种受体类型根据接触的光受体类型而分离(82,88)。
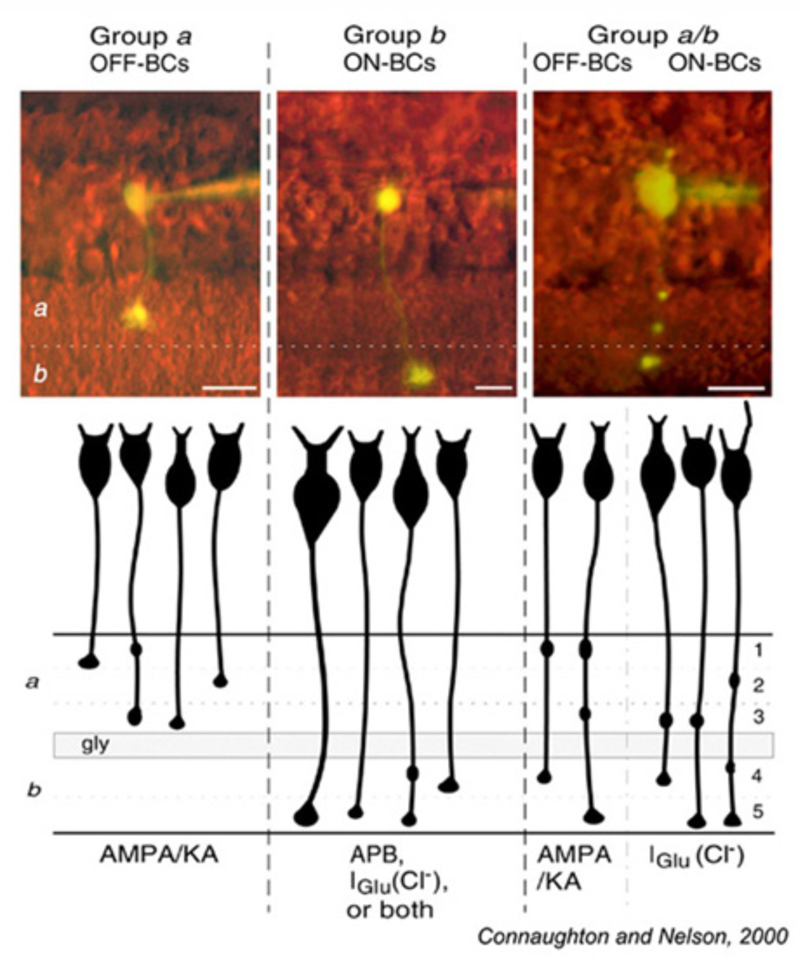
图17总结了斑马鱼a亚节(a组)和b亚节(b组)中具有轴突钮扣的双极细胞的谷氨酸反应。双极性细胞,具1或2顶端钮扣,限于其中一种一个或sublaminab遵守开、关分层规则。OFF细胞在亚层中分支一个表达AMPA/KA型受体。ON细胞分枝于亚层b表达两种谷氨酸抑制机制中的一种或两种glu,转运体样氯电流)或代谢(APB受体)。
鲤鱼视网膜(115,118)也表现出双极细胞终端的双叶状组织。
Bistratified轴突码头
在多层双极细胞轴突普遍存在的物种中,双双胺层的有序性在一定程度上被打破。而多层细胞存在于哺乳动物中,如猴子、猫和松鼠(10,15,11,120)(图2-GBB;图16 b3),这些类型在鸟类、爬行动物、两栖动物和鱼类中更为常见。多层型选择性接触球果(19,120)等可能是球果占优势的物种的特征。如果宽的或多层的双极端被限制在ON或OFF亚节中(即同一亚节中的所有分支和钮扣),则适用ON和OFF分层规则。这在地鼠b3型双极细胞中可见(图16)。然而,如果轴突分层模式跨越ON-OFF边界,细胞可能是on型或off型(11,72,103)。在某些情况下,这种多层双极细胞甚至可以同时表达ON和OFF生理学(11,88,112),其中OFF生理学由AMPA受体介导,ON生理学由mGluR6或EAAT介导。在巨型danio中,这样的细胞是颜色对手(88)。在斑马鱼中,在两个亚鳃中都发现有纽扣的多层双极细胞是ON型或OFF型(图17)。 Connaughton and Nelson concluded that multistratified ON types use only Iglu然而,Wong等人在相关的巨鱼中发现了一种既为ON又为OFF的双层型,表达了两种IgluAMPA/kainate受体(88)。其他巨型danio ON双极细胞的模式与斑马鱼相似,其中Iglu,即兴奋性氨基酸转运蛋白(EAAT),其机制尤其见于on型锥接触双极细胞,而混合的Mb棒和锥接触型同时利用EAAT和MGluR6机制(121)。谷氨酸转运蛋白阻滞剂TBOA被发现能有效阻断EAAT的传播(121)。
杆状双极细胞轴突末端和杆状通路的分层
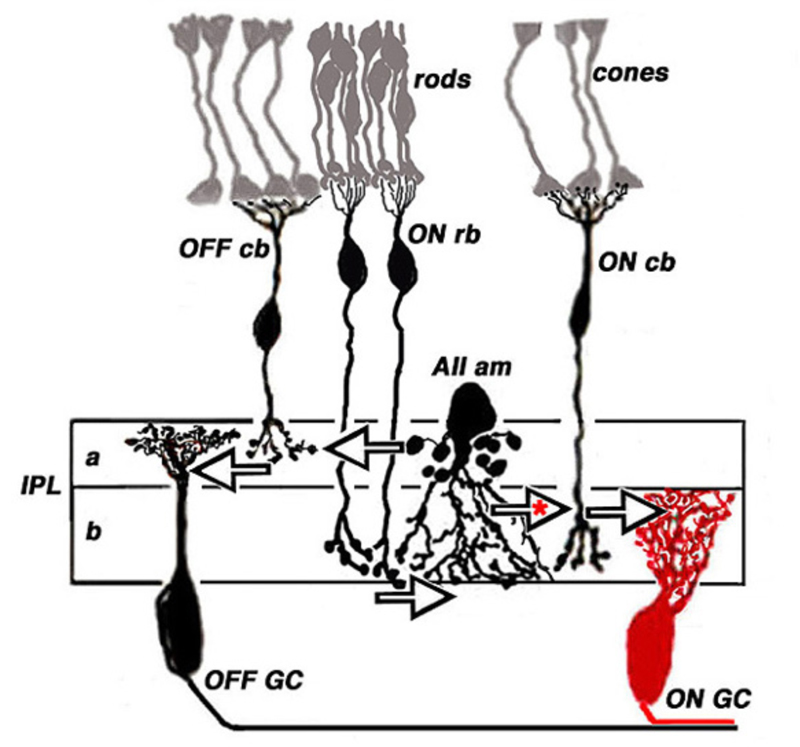
杆状双极细胞是独特的。这些细胞在哺乳动物和鱼类中都很容易识别(122)。在大多数哺乳动物中,通过轴突分层模式和与光感受器的接触来判断,只有一类杆状双极细胞(20,122)。轴突向下深入ON亚节b在IPL中,它生长在紧邻神经节细胞的球根末端(图18,rb)。哺乳动物的棒状双极细胞是一种on型细胞(123),利用代谢性apb敏感的谷氨酸受体(31,32,64,124)。在鱼类中,类似的细胞类型是Mb双极细胞(125)。在鱼的视网膜中,杆状接触双极细胞也接触视锥细胞。在金鱼的视网膜中发现了5种这样的类型,包括多种ON型,轴突末端在亚膜分支b,以及可能的OFF型,轴突末梢在椎板下分支一个(14)。有趣的是,在小鼠视网膜中也出现了多个ON型杆状双极细胞。虽然轴突末端的形态差别很小,但光诱发了DBC的信号R1完全以杆为主,而DBCR2,与鱼相似,除了杆的输入外,它还接受大量的锥信号输入。圆锥信号以DBC表示R2在连接蛋白36敲除小鼠中,类型消失(126,127)。无论哪种细胞,经典的ON-center杆状双极细胞都具有蛋白激酶C (PKC)的高免疫反应性(64,113,126,128-130)。
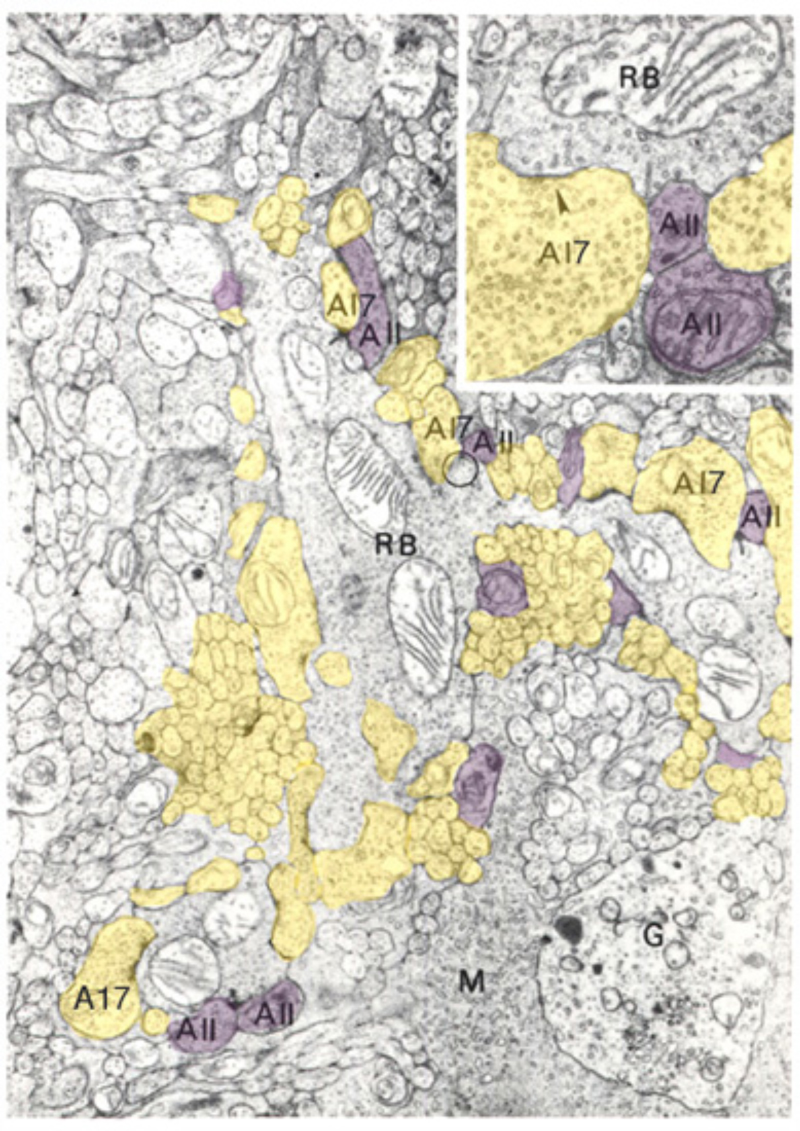
杆状双极细胞的轴突末梢虽然与神经节细胞直接相邻,但不直接接触神经节细胞。在哺乳动物的视网膜中,无分泌细胞(105,131,132)是第一个将杆状双极信号传递到神经节细胞的中介细胞。AII细胞通过IPL内锥体双极突的直接神经支配实现这一点,或通过OFF双极细胞的化学突触实现(椎板下的大箭头)一个或AII树突与ON锥双极轴突之间的贯通连接(带红色星号的大箭头,图18)。锥体双极轴突末梢是将杆状双极信号传递给神经节细胞的第二个中介。aii -amacrin -to-cone-双极缝隙连接通过细胞内cGMP途径作用的肱骨因子一氧化氮下调(133),也容易受到甲氯胺酸的药理阻断(134)。
锥体双极细胞参与了从视网膜远端到神经节细胞的ON和OFF杆信号的传递,即使没有所有的无分泌的中介作用。这是通过两种途径发生的。在第一种情况下,信号通过杆状细胞和锥体细胞之间的间隙连接(135-139),并通过这一途径进入锥体双极细胞。在第二种细胞中,锥状接触的双极细胞直接与杆状细胞进行树突接触,这在非哺乳动物中很常见(14,117,140,141)。在哺乳动物中,这种类型的锥体双极通路通常局限于OFF锥体双极细胞树突状接触杆(139,142,143)。该途径使用OFF锥双极细胞中较快的向电离途径,绕过了较慢的,尽管增益较高且更敏感的杆状双极细胞的代谢途径(143)。与典型的哺乳动物相比,小鼠视网膜的ON锥双极细胞与鱼类视网膜的ON锥双极细胞直接接触杆状细胞(144)。在人类中,无论是行为上还是诱发电位记录中,都可以区分出独立的杆状信号通路(145)。一个敏感的scotopic通路可能代表杆状双极- aii通路,而一个较不敏感和较快的中视通路可能代表杆状-锥体间隙连接通路,或者可能另外,一个直接杆状输入的OFF锥体双极通路。
4 .电性、侧抑制和突触释放
电压门控电流
电压门控通道渗透视网膜双极细胞的膜,并参与电压响应。一般来说,这些通道携带钙(钙)2 +和/或钾(K+)离子电流。细胞内记录显示双极细胞对光刺激产生梯度电位,而不是动作电位(1)。这一发现得到了几项研究的支持+双极神经元中未发现电流(146-148)。然而,其他一些研究确实报道了电压门控钠+大鼠(149-151)和金鱼(152)中一些锥双极细胞的电流。一般来说,这样的Na+电流可能不会产生动作电位,除非有时在特殊条件下,K+渠道受阻。似乎这些电流通常是用来放大突触事件和形成光响应波形的。
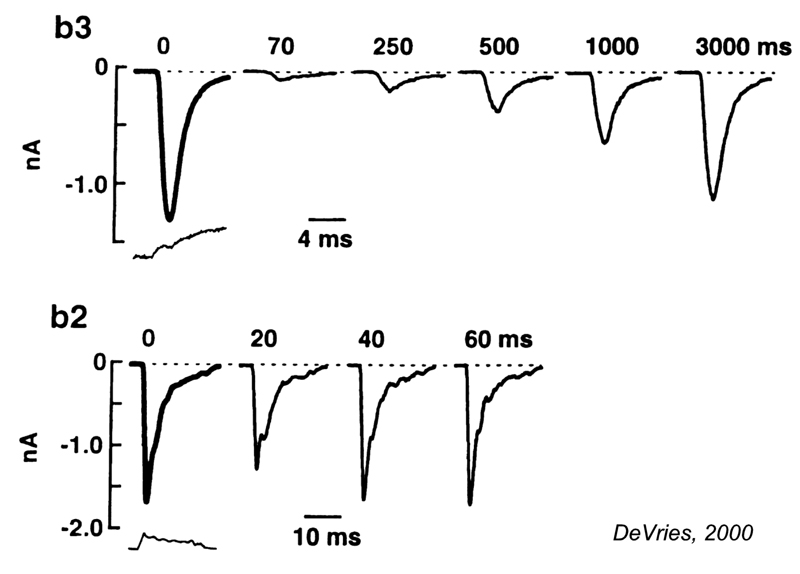
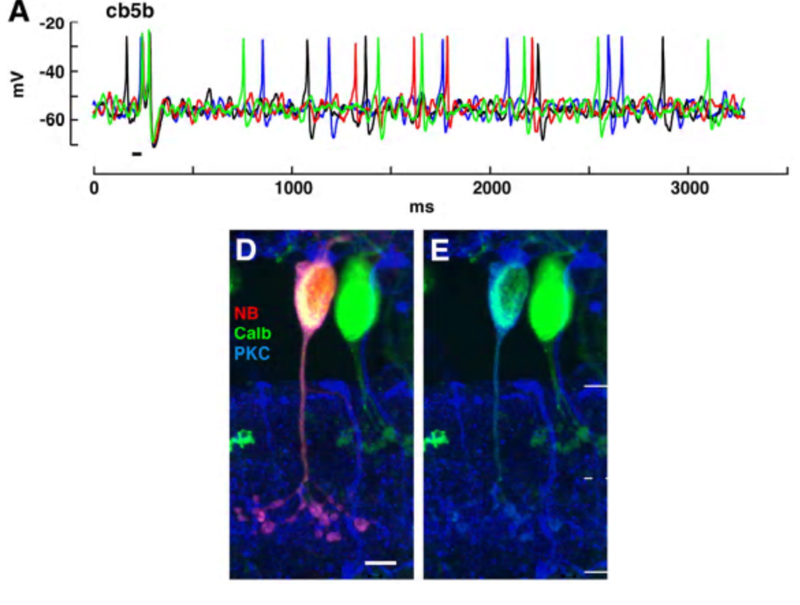
地鼠视网膜的cb5b双极细胞是一个例外。自发和光诱发的钠+使用穿孔膜片记录可以从这些双极细胞中记录峰值(图19)(5)。光诱发的双极峰值似乎触发了突触后神经节细胞中的脉冲产生。
Na+杆状双极细胞中未见尖峰。然而在鱼的视网膜中,Ca2 +在杆状双极轴突末端发现了尖刺(3,153,154)。在斑马鱼的双极性细胞转基因标记的Ca2 +荧光指示剂SyGCaMP2, 65%的双极端产生至少1个Ca2 +(4)。这表明Ca+在杆状和锥体双极细胞的轴突末端都有刺突。光诱发钙2 +刺突只在鲤系视网膜中有报道。
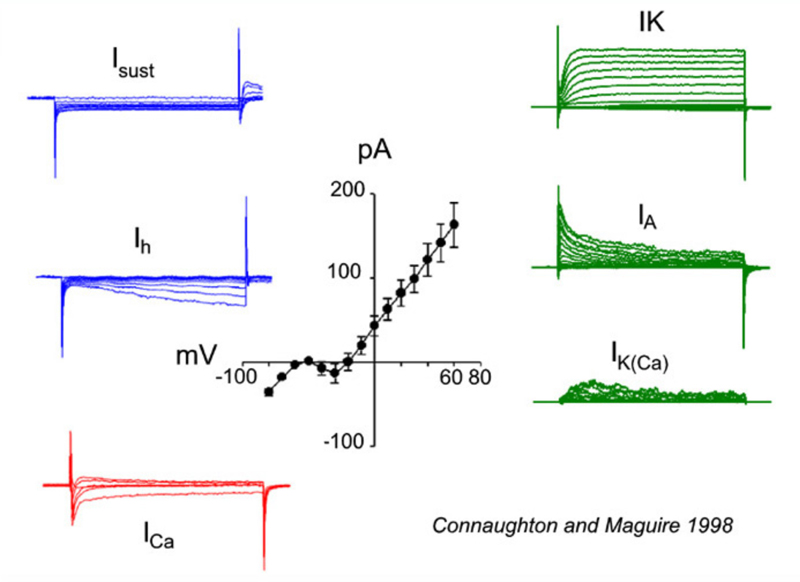
迄今所检查的双极细胞均表达向内钙2 +响应膜去极化的电流。Ca2 +电流是瞬态的(t型/低压激活)和/或持续的(l型/高压激活)。这些不同Ca的表达2 +目前的脊椎动物种类各不相同。例如,在金鱼中,l型钙2 +电流存在(155,156);而小鼠双极细胞仅表达瞬时t型电流(156,157)。然而,在蝾螈(158)和斑马鱼(146)中,T型和l型Ca2 +通道存在,l型定位于轴突末梢。斑马鱼双极细胞记录同时表达l型和t型钙2 +电流如图20所示Ca.
钾的数量(K+)电流已在双极细胞中被发现。膜去极化通常引起向外K的组合+电流。在金鱼(159)和虎蝾螈(25)的视网膜中,缓慢激活的、延迟的矫正(IK)由多巴胺(160)调节的钾电流被激活。相反,蝾螈双极神经元(161)表达快速激活、缓慢失活的I一个对去极化膜电位的响应电流。鱼的双极性细胞,如白鲈鱼和斑马鱼,表达这两种类型K中的一种或另一种+这表明这些神经元可以根据它们所表达的电压门控电流被区分为不同的群体(146,148)。膜去极化也会引起钙依赖性钾+当前的(我K (Ca)),这有助于观测到的总体向外电流振幅(146,148,159)。这些向外的电流倾向于使细胞超极化,去极化后恢复膜电位。另一方面,膜超极化引起缓慢激活的向内整流(Ih)电流(146-148,159)。这也倾向于恢复膜电位。K的例子+膜去极化引起的电流(IK,我一个,我K (Ca))或超极化(Isust,我h)显示在图20中。这些记录在斑马鱼视网膜双极细胞中。
抑制GABA-gated电流
如上所述,光刺激双极细胞感受野显示出典型的中心-周围拮抗作用(图1),其中中心的响应与周围的响应极性相反。人们认为,双极细胞光响应的中心部分来自光感受器的直接谷氨酸输入,而环绕响应则是由水平细胞抑制锥体释放谷氨酸间接产生的(162)。水平细胞对视锥细胞的反馈进一步讨论Webvision章s电位和水平细胞.
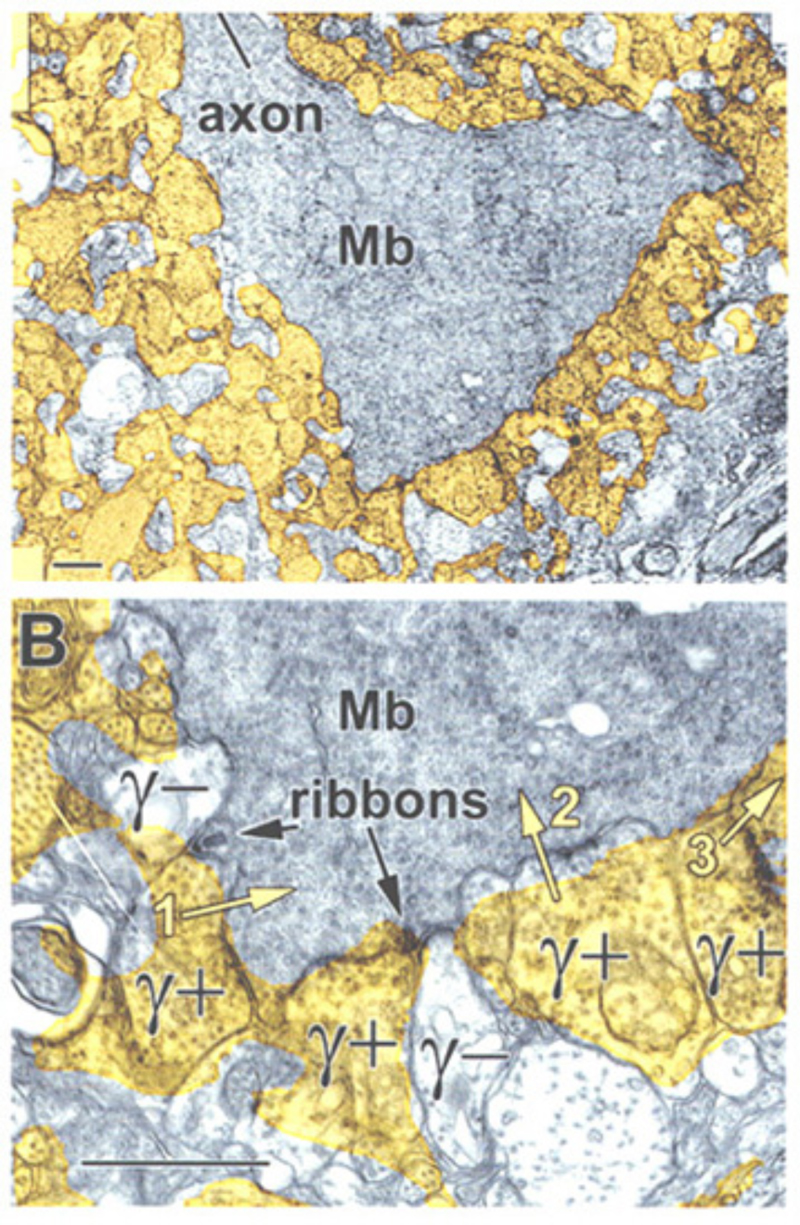
另一种潜在的环绕机制是通过水平细胞或无分泌细胞直接抑制氨基丁酸能和/或甘氨酸能输入。这些神经递质打开氯离子通道并产生超极化或去极化极性的信号,这取决于氯离子的大小(Cl−)跨越突触膜的梯度(163)。在虎蝾螈的ON双极细胞中已经观察到氯介导的光启动和光偏移反应(12,25,112)。这些成分似乎来自于氨基丁酸能和甘氨酸能抑制中间神经元的AMPA激发,而不是直接来自光感受器(25,164)。这些ON或OFF抑制的波形取决于兴奋性ON响应是杆状还是锥状支配。杆状支配的细胞往往具有持续的ON抑制,而没有短暂的抵消抑制,而锥状支配的细胞在刺激的开始和抵消时都受到短暂的抑制(112)。免疫细胞化学研究表明,双极性细胞树突和末端被GABAergic过程包围。在OPL中,这些过程属于水平细胞;而在IPL中,GABAergic无分泌细胞过程围绕双极端(165-170)。图21为cyprinid Mb(棒状双极)末端,图22为cat棒状双极细胞轴突末端,显示了围绕双极细胞轴突末端的gaba能抑制突触排列。
双极细胞过程对外界施加GABA选择性敏感(图23)。gaba诱发的电流通常在轴突末端最大(171-174),尽管从体体和/或树突可以诱发较小振幅的电流(图23)。这表明邻近的无分泌细胞(171-175)的主要抑制反馈电路通过直接输入到双极细胞端发生。gaba能输入到双极树突也可能通过涉及光感受器的反馈突触间接发生(176-179)。
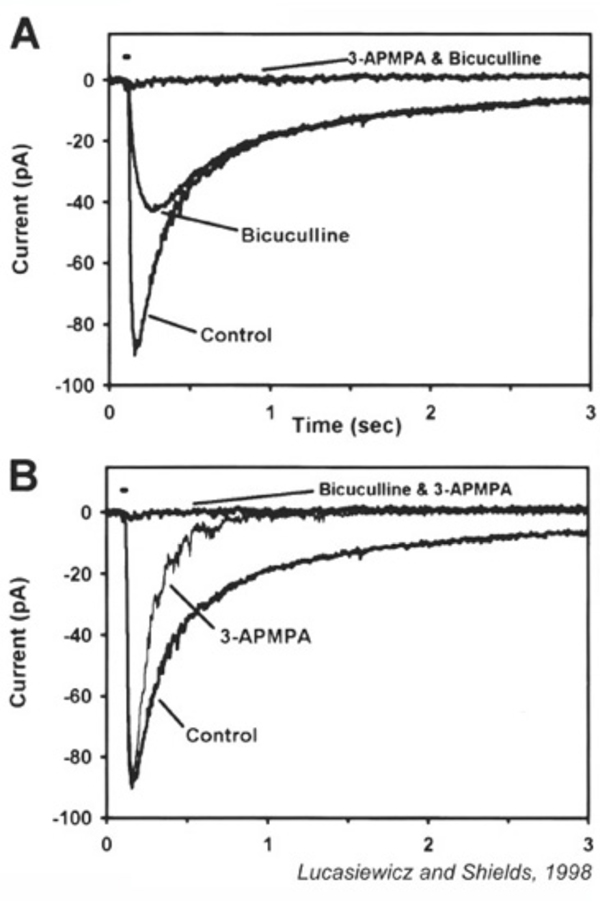
氨基丁酸的应用引起一种氯化物(Cl−)电流。取决于Cl−虽然最常见的结果是超极化,但梯度去极化或超极化可能会导致。gaba诱发的电流有瞬态和持续两部分。瞬时反应由GABA介导一个受体;而持续组分则来自于GABA的激活C受体(173年、180年- 187年)。GABA的持续组分C反应持续数分钟,超极化作用在使用氧酚醇(一种缓慢分布的探针)作为电压报告器的分离双极细胞的电压探针研究中很容易看到(171,188)。GABA的不同时间过程一个和GABAC图24显示了雪貂双极细胞的电流和对选择性拮抗剂的不同敏感性。视网膜氨基丁酸的分子性质C受体在Webvision章节中有解释脊椎动物视网膜中的GABAc受体.有趣的是,虽然大多数双极细胞似乎表达两种GABA一个和GABAC受体,就是氨基丁酸C这种受体是70-80%的gaba诱发反应的基础。在光刺激下,这些受体向双极细胞端转移的净电荷比任何一种GABA都要多一个或者甘氨酸受体(189)。两种GABA的表达一个和GABAC受体允许双极轴突末端对突触间隙内的一系列GABA浓度和时间过程做出反应,因为这些不同的受体类型对低剂量GABA的长时间应用表现出集体的高度敏感性C)和高剂量GABA的短时间应用(GABA一个)(181, 183)。
图23。从金鱼视网膜上分离出的杆状双极细胞(左)。当选定的细胞区域受到GABA微泡的刺激时,最敏感的区域是轴突末端(右)。该图由Tachibana和Kaneko, 1987(173)修改而来。
伽马氨基丁酸B是“代谢型”GABA受体。这些受体在蝾螈和金鱼双极细胞的轴突末端被发现,它们减少钙的流入(158,190),调节双极细胞谷氨酸的突触释放。
GABA抑制电路的功能后果
GABA受体影响视网膜光反应的动力学(191-194)。伽马氨基丁酸一个拮抗剂使神经节细胞ON放电变得更短暂(193,195),这一效应见于ON双极细胞(195)。Zhang等人提出了一个序列突触通路来解释这个反直觉的结果。在这个模型中,GABA的原生作用,而不是GABA拮抗剂,是通过延迟抑制使光反应更加短暂。无分泌细胞与氨基丁酸在双极细胞上形成突触C然而,突触本身会被其他利用GABA的无分泌细胞抑制一个突触。封锁氨基丁酸一个输入引起更强大的抑制双极终端GABAC以及进一步的光响应瞬变。在这个模型中,一种反直觉的行为是用一种多突触通路来解释的。伽马氨基丁酸C在双极细胞中测量到的电流在伽马氨基丁酸存在时确实增加一个拮抗剂荷包牡丹碱(189)。从无分泌细胞释放的GABA激活双极细胞末端的受体,导致抑制去极化诱导的钙电流(158,196)和相关的突触释放(197),可能调节或减少这些细胞的神经递质释放(198)。光在双极细胞突触后的无分泌细胞中诱发兴奋电流的测量表明,氨基丁酸在运动上变慢C抑制限制了兴奋性突触后事件的持续时间,而更快的甘氨酸和氨基丁酸一个抑制限制了突触后兴奋事件的峰值振幅(191)。
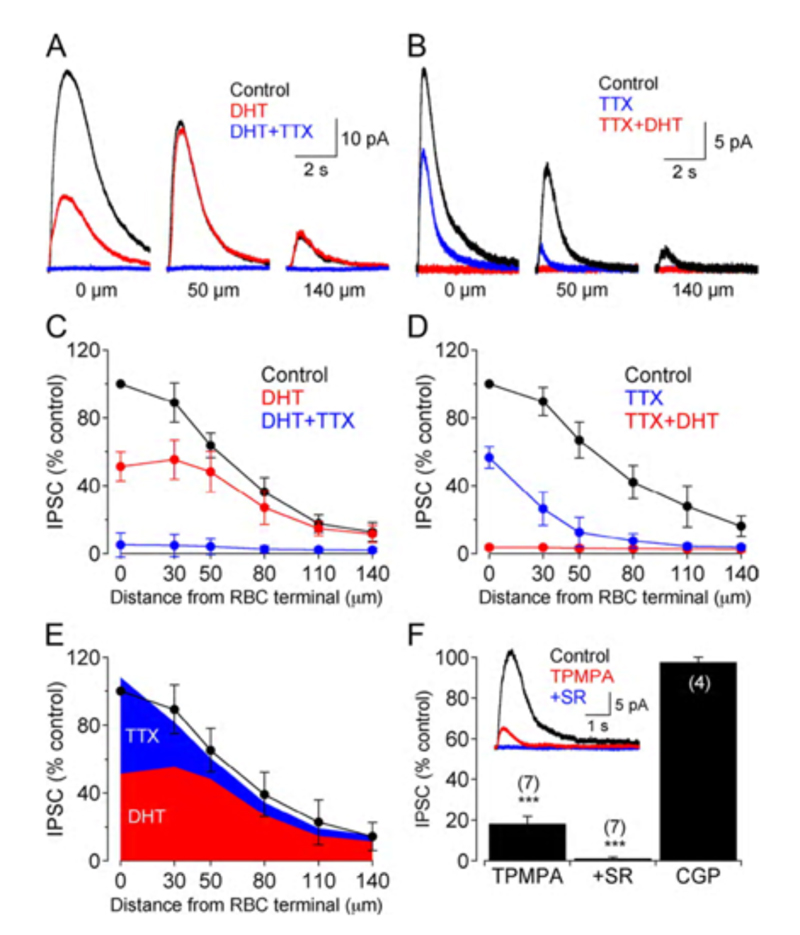
A17无分泌细胞和杆状双极细胞之间的GABA能突触(图22)激活GABA一个受体(199)。虽然树突场较宽,但A17无分泌细胞对杆状双极轴突末端的作用是局部的(200,201),并且依赖于钙通过杆状双极细胞带状突触(201)激发的A17 AMPA通道进入,而不是脉冲在A17树突中传播(200)。伽马氨基丁酸C杆状双极端子的抑制范围很长,取决于脉冲活度(200)。这两个抑制系统已经在Diamond实验室被解剖了。GABA的短程倒数一个通过用5,7二羟色胺(DHT)消融A17无分泌细胞来消除反馈,DHT是一种有毒的血清素类似物,可被A17选择性吸收。长程氨基丁酸C反馈被河豚毒素(TTX)消除。这消除了允许信号沿除A17外的无分泌细胞树突传播的神经尖刺。有趣的是,尽管树突场很宽,A17的调控作用似乎是独立的局部电路与杆状双极细胞的相互作用(图25)。
抑制glycine-gated电流
甘氨酸应用于双极细胞引起马钱子碱敏感,超极化氯电流。与GABA一样,不同的双极细胞区域对甘氨酸的敏感性不同。小鼠(156、202)和鲤鱼(177)轴突末端表现出最大的敏感性;而大鼠(147)和蝾螈(203)的树突更敏感。甘氨酸能抑制电路有选择性地撞击OFF锥双极细胞的趋势(177,204);一个突出的例子是还哺乳动物OFF锥双极细胞的无分泌神经支配(105,205 -207)。在这种情况下,甘氨酸作为一种神经递质中介,在通往黑暗适应神经节细胞中枢反应的途径中发挥作用(图18)。一般来说,锥双极细胞轴突末端的抑制途径使用甘氨酸,而杆状双极轴突末端则接受gaba能抑制(208)。然而,甘氨酸是抑制棒双极终端的一个成分。该通路由ON和OFF双极细胞支配,通过NMDA谷氨酸受体优先作用于无分泌细胞(209)。树突状脉冲传播在该突触甘氨酸抑制的传递中起作用。对来自树突和轴突末端的甘氨酸诱导电流进行噪声分析表明,每个区域可能表达不同的甘氨酸受体亚型(210)。在鱼视网膜中,双向细胞树突和轴突末端的甘氨酸能输入被认为直接来自无分泌和甘氨酸能互丛细胞群(203)。到目前为止,只在鱼的视网膜中发现过含甘氨酸的丛状细胞;甘氨酸受体可以在光受体突触后的过程中发现,包括双极细胞树突过程(211)。
甘氨酸被认为调节双极细胞的环绕光反应,尽管报道甘氨酸的作用并不一致。Stone和Schutte(1991)(212)在《Xenopus》上报道,甘氨酸的应用消除了ON型和off型双极细胞的环绕反应。相比之下,蝾螈的环绕反应不会被甘氨酸阻断(213)。GABA应用在所有双极细胞中都能引起反应,而甘氨酸仅能引起双极细胞的一个子集的反应,如鲤鱼的OFF双极细胞(177)和鳐的小场双极细胞(214),这表明甘氨酸可能在视网膜中具有选择性作用。无分泌细胞和双极细胞之间的甘氨酸能反馈连接减少光诱发的谷氨酸释放到神经节细胞树突上(198)。在哺乳动物视网膜中,甘氨酸前馈突触将所有无分泌细胞的杆状双极信号转移到OFF锥体双极终端(105,215)。因此,双极细胞上的甘氨酸突触可能在介导视网膜近端和远端神经元之间的信息传递中起重要作用。
金鱼双极细胞轴突末端囊泡释放谷氨酸
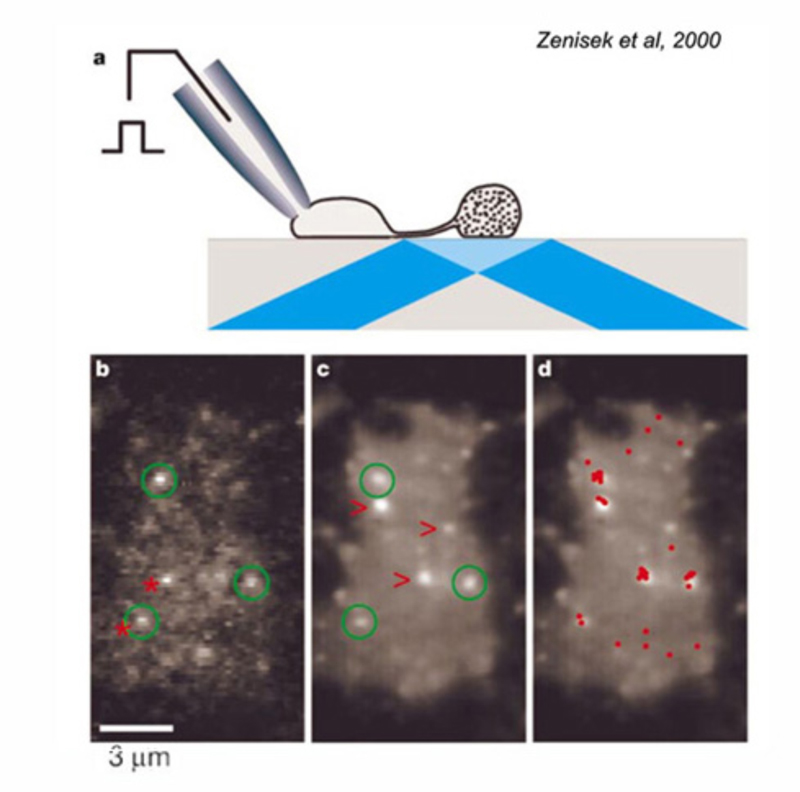
由于金鱼mb1型on -双极细胞的轴突终末体积较大,因此被用作检测神经递质释放的模型系统。轴突末端可在膜片钳研究中直接记录(216)。使用荧光钙探针可以检测到内部钙(217)和胞吐和胞吞活性(217,218)的变化,并观察在突触前末端增加或去除囊泡膜时电容的变化。在图26中,通过瞬变荧光显微镜可以看到Mb1末端释放的囊泡。
从双极端释放的神经递质发生在带状突触(21,220);传统的突触在双极轴突末端是罕见的,尽管它们在一些物种中被看到(22,222)。每个带都是垂直于等离子膜的电子密度结构。一条缎带沿其两侧可包含多达110个栓系的囊泡。沿着缎带基部的小泡,或“停靠小泡”,与突触前膜接触(216)。双极细胞轴突末端的带状突触的排列和相关的突触后事件如图27所示。所有与带状相关的囊泡构成了易释放的囊泡池。由于金鱼的一个轴突末端平均有55个活动区,每个区都有一个相关的带(218),因此每个轴突末端有大约6000个栓系或快速释放的囊泡(von Gersdorff et al., 1996)。将这些值与电容测量相结合表明,每个活性区域的最大释放速率为~500泡/秒(216)。具有较小杆状或锥状双极轴突末端的物种(两栖动物、爬行动物和哺乳动物)具有较少数量的带和较小体积的突触囊泡,因此释放速率可能与模型金鱼系统不同。
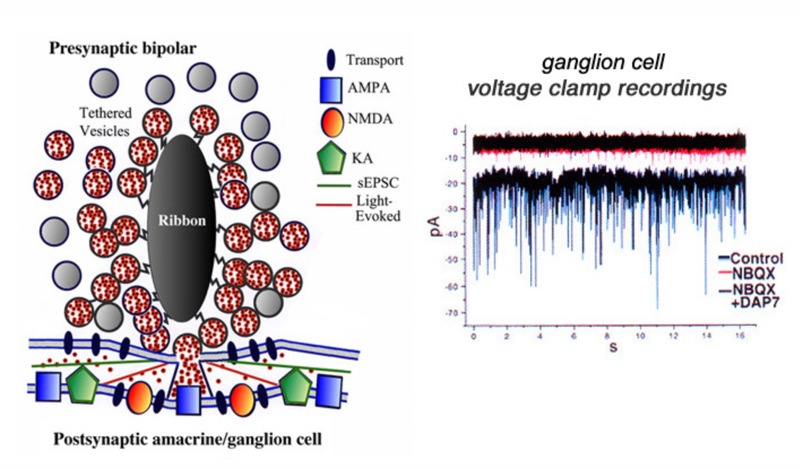
带状突触在没有光的情况下,会自发地释放囊泡。在神经节细胞中,单自发兴奋性突触后电流(sEPSCs)可以通过电压钳技术进行研究(221)。人们认为正常的自发释放会激活位于活性释放区下方的AMPA受体(图27)。光刺激ON双极细胞可诱导沿单个带状位点释放许多囊泡,谷氨酸外溢激活AMPA和NMDA受体(图27)。sEPSCs的斑块记录,在高渗林格条件下,以提高自发事件的发生率,揭示了大的和小的以及快的和慢的事件(图27,对照)。sEPSCs大部分被NBQX所清除,NBQX是AMPA和kainate受体的高选择性拮抗剂(图27,NBQX)。但在加入NMDA拮抗剂D-AP7(图27,NBQX)之前,仍可看到小振幅事件(图27,NBQX+DAP7)。这表明AMPA和NMDA受体在突触后神经节细胞中都很活跃(223)。此外,维持向内的电流也会被这两种拮抗剂阻断,这表明双极细胞的带状突触跨越宽广的时间谱传递信息。
双极带状突触的囊泡释放以钙依赖的方式发生(224-226),尽管对钙似乎没有选择性的需求,因为其他二价离子,如锶和钡,可以刺激胞吐,尽管程度较轻(227)。钙的进入发生在金鱼的l型通道(155)和/或在小鼠的t型通道(228)。这些通道位于轴突末端膜上。体内钙浓度为10-20 μM时可刺激易释放池(216,218,229)的胞吐(155)。胞吐分为两个阶段。最初,膜去极化引起电容的增加(时间常数~1.5 ms)对应于停靠泡的快速释放。随后是第二次电容增加,时间常数较慢(~250-300ms),这被认为代表了拴着的囊泡移动到活性区和随后的释放(22,230)。据估计,20%或1100个囊泡(在易释放池中的6000个囊泡中)在快速胞吐过程中被释放(229,230),其余的在缓慢胞吐过程中被释放。用大约8s(231)的时间常数重新存储耗尽的池。快相和慢相都是钙依赖性的,尽管它们对钙缓冲液表现出不同的敏感性(230)。
神经递质释放后,囊泡膜迅速恢复(226)并持续恢复(217,232)。囊泡在胞吐和胞吞过程中的持续循环与神经递质的紧张性释放是一致的(217)。这被怀疑是因为双极细胞对光产生持续的反应,至少在某些情况下,将持续的信号传递到突触后神经元(1)。尽管神经递质在末梢连续或成对脉冲刺激后释放,但释放量随时间而减少(229,230)。这种突触抑制被认为是由于易释放池的消耗和该池的胞吐减少(229)。
哺乳动物杆-双极-全顶分泌突触的囊泡释放
通过同时记录突触前和突触后细胞的贴片,研究了哺乳动物棒双极细胞和所有无分泌细胞之间的带状突触的药理学和动力学(199)。这个谷氨酸突触只使用AMPA受体(233)。在视网膜内丛状层中,存在着从双极细胞的基本持续光响应到无分泌细胞的基本短暂光响应的转变(1)。这种转变的机制是视网膜神经回路的一个主要课题。杆状双极细胞对持续光刺激的反应是持续去极化(123),而无侧分泌对光的反应是短暂的去极化(123,132)。Singer和Diamond(2003)(199)认为囊泡耗竭(至少是较高的刺激水平)是持续-短暂转化的主要因素(123,132)。杆状双极到aii突触快速,在杆状双极去极化后约1ms达到峰值。它也是瞬态的,响应于突触前杆双极的去极化矩形电压阶跃,锯齿形波形在20毫秒内衰减到较小的稳态释放水平。导致囊泡释放的突触前钙电流是l型且持续的,并不能解释其衰减(199)。即使存在抑制性突触阻断剂,也会发生持续到短暂的转化一个反馈。GABA反馈可以观察到作为延迟的瞬态外向电流在杆双极记录,但没有测量改变突触释放。
在反应的衰减阶段结束后,小突触事件的残余序列继续存在。瞬时波形变慢,但很明显,即使在刺激阈值(199)。Singer和Diamond(2003)得出结论,“可释放池”内的突触前囊泡耗竭是突触瞬时波形的原因。随着时间的推移,可用囊泡数量的减少会减少释放的囊泡数量,即使对于单个囊泡来说,这个概率可能保持不变。这是典型的突触传递。然而,该突触的一个独特特征是囊泡对的同步释放(234)。Singer和Diamond(2006)(235)估计,在大鼠棒状双极细胞终端中,可轻易释放的池在净约70个囊泡中,相当于每个带约7个囊泡。该突触似乎能够以约0.5个泡/毫秒的速度取代囊泡,使每个带的稳态释放速率约为50/秒。在成对脉冲实验中释放很容易被抑制,恢复时间仅为4 s左右,但持续的胞吐似乎加速了囊泡的恢复。这些特性可能赋予基于突触的神经适应能力(235)。
双极细胞异常的行为和临床意义
ON双极细胞似乎特别容易受到侮辱。例如,mGluR6受体可以被选择性地移除(即敲除),而不会对其他神经通路产生重大影响。这可以通过多种技术来实现,例如使用选择性药理阻断剂(即APB)或定位诱变技术,旨在消除mGluR6受体本身(图4)。此外,与mGluR6相关的自然发生的突变和疾病过程选择性地靶向双极细胞。其中包括TRPM1通道的损伤(图7),以及相关的糖蛋白nyctalopin(图9)。其他疾病过程也会挑选出ON双极细胞。令人惊讶的是,有ON-bipolar缺陷的人类或动物模型在执行视觉任务时相对正常。主要问题是夜间视力的丧失,这似乎依赖于一个单on双极细胞类型的生理完整性,即哺乳动物的杆状双极细胞。
ON双极敲除小鼠执行视觉任务
针对mGluR6缺陷小鼠的ON通路定点诱变的电生理结果如图4所示。由ON双极细胞活性产生的视网膜电b波成分被取消(31)。这些作者进一步证明了来自上丘的光诱发场电位,在小鼠中是神经节细胞轴突的主要终止点,缺乏ON反应,尽管off型波出现。在野生型小鼠中,在光刺激开始和停止时都可以看到瞬时脑波。mGluR6生理机能的改变似乎意味着行为缺陷。
有趣的是,一些测试确实显示了行为缺陷,而另一些则没有。在穿梭箱回避学习分析中,突变型和野生型小鼠都表现得同样好(31)。自从最初的位点导向突变系建立以来,又发现了一个前向遗传的mglur6突变系nob4(236)。昼夜节律时钟的特征是在黑暗阶段的轮跑活动,在两种突变体中都是正常的。在每一种突变光中都停止这种活动(237,238)。在位点导向突变体中,这种作用是相位延迟的(237);在nob4中,这个动作被敏化了,这是一个看似矛盾的结果(238)。两种突变体的瞳孔反应仅在高光水平下观察到(238,239)。位点定向突变的视动反应仅在高对比度下可见(239),提示敏感性普遍丧失。这些研究表明,OFF双极细胞可以调节视力,即使有些损害。 Interestingly the ON and OFF layering of the inner plexiform layer persists in the site-directed mutant (240).
与黑素瘤相关视网膜病变(3月)
一些恶性黑素瘤患者失去夜视能力。他们可能会进一步报告由闪烁的白光斑点组成的幻觉(239,240)。日光下的视觉处理在其他方面似乎是正常的。色觉不会受到影响,视力也不会急剧恶化。视网膜电图显示这些患者的双极细胞缺损。与mGluR6缺陷的小鼠一样,在杆和锥驱动反应中b波选择性缺失(241),患者可能会降低对比敏感度(242)。虽然最初被认为是化疗的副作用(241),但很明显,该综合征可能在化疗前的癌症患者中出现(22,243)。当将MAR患者的IgG血清片段注射到猴子的眼睛中时,可诱导与MAR相似的可逆视网膜电图紊乱(244)。视网膜电图a波和d波保留,杆状和锥状反应的b波丢失(图28)。MAR似乎是由自身免疫攻击视网膜ON双极细胞引起的杆状和锥体视觉。 Antibodies induced by the melanoma cause the visual deficit. One of the epitopes appears to be the ON-bipolar-cell TRPM1 channel (245, 246), perhaps not surprisingly as the channel name derives from ‘melanoma related’. MAR is one of several paraneoplastic retinopathies (PR) or cancer-associated retinopathies (CAR).
先天性静止性夜盲症
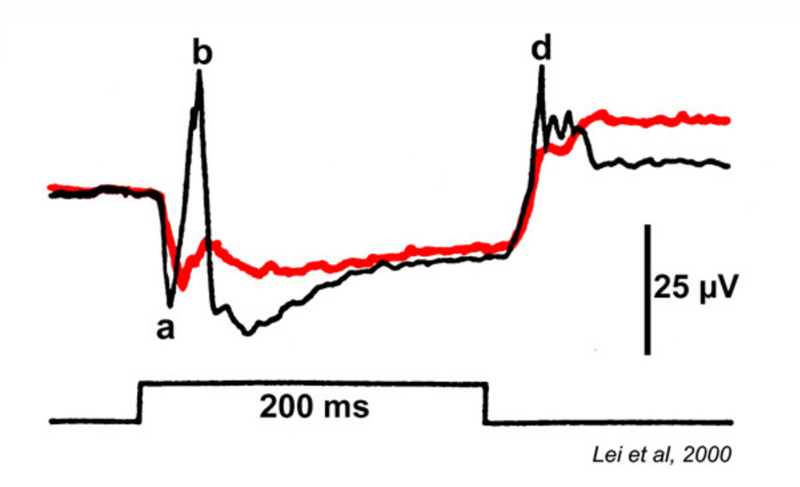
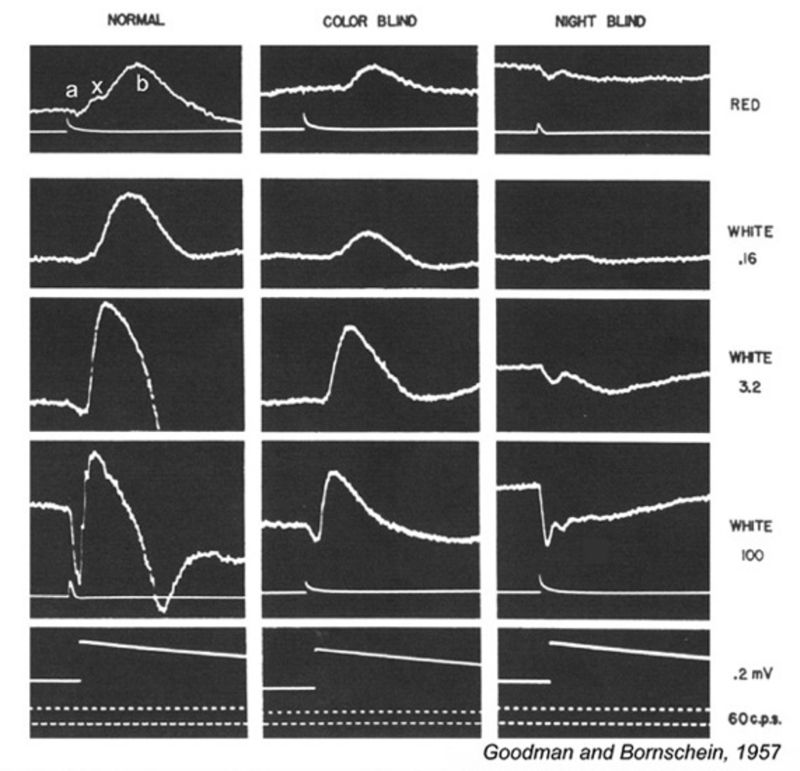
这种视觉功能障碍是一种遗传性视网膜疾病,其症状与mar非常相似。在Schubert-Bornschein完全性视网膜疾病(248)中,有夜间视力或视杆视力的丧失(图29),但在日光下,视锥介导的色觉和视力相对正常(249,250),尽管视锥视力的敏感性有所降低(250,251)。该疾病与x相关,主要影响男性(250,251)。
视网膜电图(图29)显示杆状系统和锥状系统都有b波损失。ON双极细胞信号出现严重抑制或缺失,OFF锥双极信号,如视网膜电图d波所示,被保留(241),棒a波(249)也是如此。杆状a波的存在而不是b波的存在,首次表明视网膜可能有后受体(神经处理机制)的遗传疾病(249)。
很早就发现CSNB是一种异质性疾病。Miyake等人(250)将CSNB分为“完全”和“不完全”。“完整型”或“舒伯特-波恩申型”缺乏所有的杆功能,也没有b波。“不完全”或“里格斯”型的b波和杆功能减弱。“完整”和“不完整”的形式几乎都只发生在男性身上(55个例子中的50个)(250个),所以两者都是x连锁的,但一个家族树中的多个例子只属于一种类型。遗传分析显示CSNB的完整形式涉及糖蛋白nyctalopin的缺陷(252)。该基因缺陷的动物模型出现在切片中ON双极细胞的代谢反应.突变蛋白破坏ON双极细胞的神经传递。不完全CSNB的遗传缺陷定位于视网膜中唯一表达的一个基因,类似于l型钙通道α亚基(253)。这个基因的缺陷,CACNA1F,提供了一个人类视网膜通道病的例子。
也有人类基因突变的例子GRM6基因,编码mGluR6的基因。这种缺陷也会导致CSNB,一种称为“arCSNB”的类型,“ar”代表“常染色体隐性遗传”。在这种类型中,在棒阈值附近的异常15Hz闪烁响应区分电表型(254)。作者将这种相位逆转的scotopic阈值反应解释为一种替代杆路径的存活,可能是2杆路径模型的一个元素(145)。最近,另一种常染色体隐性形式的“完全CSNB”已被确认。这在女性中尤为常见。on -双极细胞TRPM1阳离子通道是遗传缺陷(62)。在这种情况下,15Hz杆闪烁类似于X-linked (尼克斯- / -) CSNB。以上讨论了这些缺陷的动物模型ON双极细胞的代谢反应).
6 ON双极细胞mGluR6阻断下的视觉处理
外侧膝状和皮层神经元。
利用代谢性谷氨酸受体激动剂APB (DL AP-4)研究了在on -双极阻断条件下,灵长类动物中枢神经系统视觉神经元的反应。来自膝状外侧背核(LGNd)的记录表明,on -中心膝状神经元的光响应完全被APB阻断(255,256)。兔的ON-center膝状细胞也被选择性阻断(257)。视网膜神经节细胞投射到膝状继电细胞上的生理类型是有选择性的(258),因此ON和OFF通路被保留,并可被视网膜阻滞剂选择性地影响。
视觉皮层单个神经元的光反应记录表明,这是ON和OFF双极细胞信号及其相关视网膜神经元的最终整合部位。复合皮质细胞在ON双极细胞的APB阻断下继续反应,但对穿过感受野的明亮方块的前缘反应丢失(255)。这些皮层细胞的定向选择性和定向选择性似乎不受封锁的影响(255)。在一项平行研究中,研究人员发现,处于APB封锁下的猴子对光增量的感知比光衰减的感知差得多,但对同时空间对比的感知相对没有受损(259)。在哺乳动物中,所有ON双极型的突触功能消失后,留下了一个功能惊人的视觉系统。beplay体育公司
微光反应需要ON双极细胞
杆状细胞主导的哺乳动物视网膜的一个共同特征是杆状细胞(64,123,124)出现单一的on型双极细胞,主要由代谢、mGluR6、谷氨酸受体和相关分子主导。药物阻断这一途径会导致夜视生理缺陷。对于光的增加和减少(260),以及ON或OFF神经节细胞的昏暗光反应(205),行为上都是如此。敲除mglur6缺陷小鼠的ON双极细胞信号会导致视网膜电图显示的光敏感性丧失(31)。如上所述,人类双相细胞疾病总是伴随着夜间视力的丧失。次级杆通路利用锥体系统OFF双极细胞或杆和锥体之间的间隙连接通路,似乎不参与杆状介导的夜间视觉,而是杆状双极细胞代谢受体介导昏暗的光反应。
7总结与结论
双极细胞是功能上至关重要的神经元,构成了通过视网膜的垂直转导通路的中间部分。ON型和off型双极细胞是视网膜内丛状层中类似极化神经节细胞的突触前细胞,可以通过形态、光响应和不同类型的树突谷氨酸受体表达来区分。这些细胞作为模型,用于研究神经生物学的不同方面,包括胚胎发育、突触后受体系统、神经递质释放机制、神经回路相互作用和视觉系统缺陷。beplay体育公司ON和OFF双极细胞启动两种功能独立的通路,ON和OFF,每一种都有中心环绕的组织,每一种都有分裂为两极细胞突触后的瞬时和持续信号类型。每个双极通路都能独立处理图像。ON和OFF双极细胞的信号分别传递到更高的大脑中枢。ON双极细胞似乎选择性地易受疾病、遗传缺陷或药物攻击的影响。ON双极细胞的丧失导致夜间视力的丧失。
参考文献
1.维尔布林,F.S.和J.E.道林,泥鳅视网膜的组织,黄斑泥鳅。2细胞内记录。J Neurophysiol, 1969。32(3): 339 - 55页。[PubMed]
2.Kuffler白雪,哺乳动物视网膜放电模式与功能组织。J Neurophysiol, 1953。16(1): 37 - 68页。
3.普罗蒂,地方检察官,n·弗洛雷斯-赫尔和h·冯·格斯多夫,光唤起Ca2 +视网膜双极细胞轴突末端的刺突。神经元,2000年。25(1): 215 - 27页。
4.Dreosti, E.等人,活体证据表明视网膜双极细胞产生由光调制的尖刺。Nat >, 2011。14(8): 951 - 2页。
5.萨兹克,s·s·h·德弗里,哺乳动物视网膜双极细胞利用膜电压的渐变变化和全或无钠+用来编码光线的尖刺J >, 2012。32(1): 297 - 307页。
6.康诺顿,副总裁,d·格雷厄姆,r·尼尔森,斑马鱼视网膜内水平、双极和无分泌细胞的鉴定和形态分类。比较神经学杂志,2004。477: 371 - 385页。
7.欧拉,T., H. Schneider和H. Wässle,大鼠视网膜切片中双极细胞的谷氨酸反应。J >, 1996。16(9): 2934 - 44页。[PubMed]
8.科尔布,H。r。尼尔森和a。马里亚尼,猫视网膜的无分泌细胞、双极细胞和神经节细胞:高尔基体研究。视觉Res, 1981。21(7): 1081 - 1114页。[PubMed]
9.Wässle, H.和B.B.抵制,哺乳动物视网膜的功能结构。杂志牧师,1991年。71(2): 447 - 80页。
10.西方,R.W。,地鼠视网膜的光镜和电子显微镜:功能的考虑。神经科学杂志,1976。168(3): 355 - 77页。
11.吴思明,高峰,B.R. Maple,视网膜内突触的功能结构:通过双极细胞轴突终末的分层分离视觉信号。J >, 2000。20.(12): 4462 - 70页。[PubMed]
12.伺服电动机,脊椎动物视网膜的突触组织:一般原理和物种特异性变异:弗里登瓦尔德讲座。投资眼科视觉科学,2010。51(3): 1263 - 74页。
13.抵制,B.B.和H. Wässle,灵长类动物视网膜双极细胞的形态学分类。神经科学杂志,1991。3.(11): 1069 - 1088页。
14.石田,a.t., W.K.斯特尔,D.O.莱特福特,杆状和锥体输入到金鱼视网膜的双极细胞。神经科学杂志,1980。191(3): 315 - 35页。[PubMed]
15.李,W.和S.H.德弗里斯,哺乳动物视网膜中用于颜色和亮度视觉的双极细胞通路。Nat >, 2006。9(5): 669 - 75页。
16.麦克尼尔,高卢文学硕士和文学硕士,兔视网膜生物ocytin宽场双极细胞选择性接触蓝色锥细胞。神经科学杂志,2008。506(1): 6 - 15页。
17.马里安尼,美国专利,视网膜灵长类动物视网膜外丛状层的神经元组织1984年。86: 285 - 320页。
18.马沙克,d.w.,等人,免疫反应性胆囊收缩素前体在猕猴视网膜上的双极细胞和分泌细胞的定位。J >, 1990。10(9): 3045 - 55页。
19.斯科尔斯,J.H鲤类鱼视网膜中的颜色受体及其突触连接。生物学杂志,1975。270(902): 61 - 118页。[PubMed]
20.科尔布、H。灵长类动物视网膜外丛状层的组织:高尔基细胞的电子显微镜。皇家学会哲学汇刊,伦敦,B, 1970。258: 261 - 283页。
21.阿尤布,G.S.和D.R.哥本哈根,应用荧光法测定单一视网膜光感受器释放谷氨酸。神经科学方法杂志,1991。37(1): 7 - 14页。[PubMed]
22.纳尔逊,R。视网膜神经元电特性的比较。J Neurophysiol, 1973。36(3): 519 - 535页。[PubMed]
23.丰田章男,J。鲤鱼视网膜中双极细胞反应的膜阻力变化。视觉Res, 1973。13(2): 283 - 94页。[PubMed]
24.达歇,R.F.和R.F.米勒,泥兔视网膜眼杯灌注光感受器-双极细胞的传递。科学,1976。191(4230): 963 - 4页。[PubMed]
25.Lasansky、。蝾螈视网膜切片去极化双极细胞对中心照明的响应特性。大脑Res, 1992。576(2): 181 - 96页。[PubMed]
26.Hirasawa H. R. Shiells和M. Yamada,一种代谢性谷氨酸受体调节鲤鱼视网膜切片锥体突触前末梢的递质释放。医学杂志,2002。119(1): 55 - 68页。[PubMed]
27.阿瓦拉玛尼,G.B.和M.M.斯劳特,中枢突触突触前代谢性谷氨酸受体的强度依赖性快速激活。J >, 2001。21(2): 741 - 9页。[PubMed]
28.斯勒特,M.M.和R.F.米勒,2-氨基-4-膦丁酸:视网膜研究的新药理学工具。科学,1981。211(4478): 182 - 5页。[PubMed]
29.Nakajima, Y.等人,对l -2-氨基-4-膦酸丁酸具有高选择性的视网膜代谢性谷氨酸受体mGluR6的分子表征。生物化学杂志,1993。268(16): 11868 - 73页。[PubMed]
30.野村,A.等人,大鼠杆状双极细胞中代谢性谷氨酸受体突触后定位的发育调控。细胞,1994。77(3): 361 - 9页。[PubMed]
31.马苏,M.等人,通过靶向破坏mGluR6基因对视觉传递中ON反应的特异性缺失。细胞,1995。80(5): 757 - 65页。[PubMed]
32.Vardi, N.等人,mGluR6在灵长类动物视网膜ON双极细胞树突上的定位。神经科学杂志,2000。423(3): 402 - 412页。
33.瓦迪,N。G的亚单位o定位于ON双极细胞的树突尖端。神经科学杂志,1998。395(1): 43-52页。[PubMed]
34.丁格拉,A.等人,ON双极神经元的光响应需要Gαo.J >, 2000。20.(24): 9053 - 8页。[PubMed]
35.Vardi, N.等人,去极化棒双极细胞中g蛋白的鉴定。Vis >, 1993。10(3): 473 - 8页。[PubMed]
36.Nawy s和C.E. Jahr,谷氨酸对视网膜双极细胞cgmp激活电导的抑制。自然,1990年。346(6281): 269 - 71页。[PubMed]
37.Nawy、S。代谢受体mGluR6可能通过Go在视网膜双极细胞中无磷酸二酯酶。J >, 1999。19(8): 2938 - 44页。[PubMed]
38.小池,C,等。TRPM1是mGluR6级联中视网膜ON双极细胞转导通道的组成部分。美国国家科学院学报,2010。107(1): 332 - 7页。
39.小池,C,等。TRPM1:脊椎动物负责视网膜ON双极功能的TRP通道。细胞钙,2010。48(2 - 3): 95 - 101页。
40.Nakamura, M.等人,TRPM1突变与完全性先天性静止性夜盲症有关。摩尔Vis, 2010年。16: 425 - 37页。
41.Xu Y.和N. Vardi,g蛋白亚基对视网膜ON双极细胞光激活阳离子通道的调节作用。ARVO会议文摘,2010。51(5): 4797页。
42.Xu, Y.,等,mGluR6缺失导致视网膜TRPM1通道失活。J Neurophysiol, 2011。
43.Montell, C.和G.M. Rubin,果蝇trp位点的分子特征:一种推测的光转导所需的完整膜蛋白。神经元,1989年。2(4): 1313 - 23页。
44.迈尔斯,B.R,等人,多个无偏前瞻屏幕识别色氨酸通道及其保守门控元素。医学杂志,2008。132(5): 481 - 6页。
45.阿布拉莫维茨,J.和L.比恩鲍默,典型瞬时受体电位通道的生理学和病理生理学。美国实验生物学学会联合会J, 2009。23(2): 297 - 328页。
46.Montell, C。阳离子通道的TRP超族。Sci抽烟可以,2005年。2005(272): p . re3。
47.蒙特尔,C.比恩鲍默和V.弗洛克齐,色氨酸通道是一个功能非常强大的家族。细胞,2002。108(5): 595 - 8页。
48.Nishida M.和H. Kurose,色氨酸通道在心肌肥厚发展中的作用。Naunyn schmiedeberg Arch Pharmacol, 2008。378(4): 395 - 406页。
49.Krizaj、D。小鼠体内钙通道的区隔化。神经科学杂志,2005。22(12): 3292 - 6页。
50.柯,j.b.,等人,培养的大鼠视网膜无分泌细胞自发抑制性突触后电流的表征。神经科学,2010。165(2): 395 - 407页。
51.索萨,R.等人,视网膜无分泌细胞中的代谢性谷氨酸受体5和钙信号。J Neurochem, 2002。81(5): 973 - 83页。
52.摩根,c.w.,等人,视网膜on -双极细胞的去偏光响应需要TRPM1。美国科学院学报,2009。106(45): 19174 - 8页。
53.沈,Y.,等,瞬时受体电位样通道介导双极杆状细胞的突触传递。J >, 2009。29(19): 6088 - 93页。
54.小池,C,等。TRPM1在视网膜双极细胞中的功能分析。>, 2007。58岁的年代: S41页。
55.摩根斯,c.w., R.L.布朗和R.M.杜瓦辛,TRPM !:视网膜on -双极细胞中mGluR6信号转导级联的终点。Bioessays, 2010年。32: 609 - 614页。
56.Koyasu, T.,等人,mglur6缺陷小鼠的视网膜电图。Curr Eye Res, 2008。33(1): 91 - 9页。
57.格雷格,r.g.,等人,在完全性x相关性先天性静止性夜盲症的小鼠模型中,视网膜双极细胞中尼克斯托肽的表达恢复了视觉功能。J Neurophysiol, 2007。98(5): 3023 - 33页。
58.帕杜,m.t.等人,自然发生的x连锁先天性静止性夜盲症小鼠模型。眼科科学,1998。39(12): 2443 - 9页。
59.格雷格,r.g.,等人,识别与小鼠nob表型相关的基因和突变。投资眼科视觉科学,2003。44(1): 378 - 84页。
60.施洛特,e.h.,黄R.O.和格雷格,转nyx::MYFP斑马鱼视网膜on -双极细胞轴突终端的体内发育。Vis >, 2006。23(5): 833 - 43页。
61.曹,Y., E. Posokhova和K.A. Martemyanov,TRPM1与奈克托宾在体内形成复合物,并以mglur6依赖的方式在on -双极神经元突触后室中积累。J >, 2011。31(32): 11521 - 6页。
62.van Genderen, m.m.等人,TRPM1突变是完全性先天性静止性夜盲症的常见原因。Am J Hum Genet, 2009。85(5): 730 - 6页。
63.Nawy、S。钙对双极细胞mGluR6通路的调控作用2 +.J >, 2000。20.(12): 4471 - 9页。[PubMed]
64.山下M.和H. Wässle,从大鼠视网膜分离的杆状双极细胞对谷氨酸激动剂2-氨基-4-膦丁酸(APB)的反应。J >, 1991。11(8): 2372 - 82页。[PubMed]
65.谢尔斯,R.A.和g。福尔克,细胞内钙含量增加2 +角鲨视网膜双极细胞的光适应基础。物理学报,1999。514(Pt 2)第343-50页。
66.谢尔斯,R.A.和g。福尔克,激活的钙2 +-钙调素激酶II通过背景光诱导角鲨视网膜双极细胞脱敏。杂志,2000年。528 Pt 2: p。327 - 38。[PubMed]
67.沃尔特斯,r.j., R.H.克莱默和S.纳维,钙/钙调蛋白依赖性激酶对双极细胞cgmp依赖性电流的调节。Vis >, 1998。15(2): 257 - 61页。[PubMed]
68.斯奈尔曼,j.s Nawy,cgmp依赖性激酶调节小鼠双极细胞的反应敏感性。J >, 2004。24(29): 6621 - 8页。
69.阿瓦拉玛尼,G.B.和M.M.斯劳特,视网膜神经节细胞短暂和持续反应的起源。J >, 2000。20.(18): 7087 - 95页。[PubMed]
70.恩罗斯-库格尔,c·j·g·罗布森,猫视网膜神经节细胞的对比敏感度。杂志,1966年。187(3): 517 - 52页。[PubMed] [免费全文在PMC]
71.Demb, j.b.,等人,在哺乳动物视网膜的Y神经节细胞中,双极细胞参与非线性空间累加。J >, 2001。21(19): 7447 - 54页。[PubMed]
72.康诺顿,副总裁和r·纳尔逊,斑马鱼视网膜双极细胞的轴突分层模式和谷氨酸门控电导机制。杂志,2000年。524(Pt 1):第135-146页。[PubMed]
73.格兰特,G.B.和J.E.道林,白鲈视网膜双极细胞上谷氨酸激活的氯电流。J >, 1995。15(5): 3852 - 62页。[PubMed]
74.格兰特,G.B.和J.E.道林,硬骨鱼视网膜的双极细胞反应由两种不同的机制产生。J Neurophysiol, 1996。76(6): 3842 - 9页。[PubMed]
75.格兰特,G.B.和F.S. Werblin,在虎蝾螈的杆状光感受器中谷氨酸诱导的具有转运体性质的氯化物电流。Vis >, 1996。13(1): 135 - 44页。[PubMed]
76.Picaud s.a.等人,虎蝾螈锥体光感受器中具有谷氨酸转运体样特性的谷氨酸门控氯通道。J Neurophysiol, 1995。74(4): 1760 - 71页。[PubMed]
77.立花,m.a Kaneko,l -谷氨酸诱导的光感受器去极化:一个可能有助于光感受器在原位之间相互作用的过程。美国科学院学报,1988。85(14): 5315 - 9页。[PubMed] [免费全文在PMC]
78.Wersinger, E.等人,谷氨酸转运体EAAT5在小鼠杆状双极细胞中作为突触前受体。杂志,2006年。577(Pt 1):第221-34页。
79.奥蒂斯,T.S.和C.E.贾尔,阴离子电流和通过神经谷氨酸转运体预测谷氨酸通量。J >, 1998。18(18): 7099 - 110页。[PubMed]
80.Arriza, j.l.,等人,兴奋性氨基酸转运蛋白5,一种视网膜谷氨酸转运蛋白,偶联于氯化物电导。美国国家科学院,1997。94(8): 4155 - 60页。
81.Saito, T, H. Kondo和J. Toyoda,鲤鱼视网膜中两种中心上双极细胞的离子机制。2环形照明的响应。J Gen Physiol, 1981。78(5): 569 - 89页。[PubMed]
82.Saito, T, H. Kondo和J.I. Toyoda,鲤鱼视网膜中两种中心上双极细胞的离子机制。一、对中心照明的响应。医学杂志,1979年。73(1): 73 - 90页。
83.Vardi, N.等人,哺乳动物锥体“突触复合体”的神经化学。视觉Res, 1998。38(10): 1359 - 69页。[PubMed]
84.休斯,T.E在小鼠视网膜的杆状双极细胞上是否有嗜离子谷氨酸受体?Vis >, 1997。14(1): 103 - 9页。[PubMed]
85.休斯,t.e., I.赫曼斯-博格梅耶和S.海涅曼,谷氨酸受体基因(GluR1-5)在大鼠视网膜中的差异表达。Vis >, 1992。8(1): 49-55页。
86.纳尔逊,R.等人,游离斑马鱼视网膜神经元中与红氨酸受体免疫反应性相关的生理反应:电压探针研究。大脑研究,2001年。131: 255 - 65页。[PubMed]
87.彭玉伟,等,谷氨酸受体亚型在脊椎动物视网膜中的分布。神经科学,1995。66(2): 483 - 97页。[PubMed]
88.Wong K.Y.和J.E. Dowling,巨型达尼奥视网膜双极细胞输入机制:III。开-关双极细胞及其颜色对抗机制。J Neurophysiol, 2005。94(1): 265 - 272页。
89.Pourcho, r.g., P. Qin和D.J. Goebel视网膜NMDA受体亚基NR2B的细胞和亚细胞分布。神经科学杂志,2001。433(1): 75 - 85页。[PubMed]
90.Wenzel, A.等人,视网膜中含有NR2D亚基的n -甲基- d -天冬氨酸受体在杆状双极细胞中选择性表达。神经科学,1997。78(4): 1105 - 12页。[PubMed]
91.Brandstatter, j.h.,等人,NMDA和高亲和力红氨酸受体亚基信使rna在成年大鼠视网膜中的表达。神经科学杂志,1994。6(7): 1100 - 12页。
92.S.H DeVries,双极细胞利用蓝氨酸和AMPA受体将视觉信息过滤到单独的通道中。神经元,2000年。28(3): 847 - 56页。[PubMed]
93.德弗里斯,S.H.和E.A.施瓦茨,在哺乳动物视网膜中,钾酸盐受体介导视锥细胞和' Off '双极细胞之间的突触传递。自然,1999年。397(6715): 157 - 60页。[PubMed]
94.帕特南,a.v., M.莫拉莱斯,J.莱尔马,AMPA受体的选择性拮抗揭示了海马神经元中红氨酸受体介导的反应。神经元,1995年。14(1): 185 - 9页。[PubMed]
95.琼斯,k.a.等人,钾酸盐、谷氨酸和4-甲基谷氨酸的非对映体对钾酸盐受体的脱敏作用。神经药理学,1997年。36(6): 853 - 63页。[PubMed]
96.Maple, b.r., F. Gao和S.M. Wu,谷氨酸受体在杆状和锥状支配的偏心双极细胞中不同。Neuroreport, 1999年。10(17): 3605 - 10页。[PubMed]
97.维索洛斯卡、r·纳尔逊和v·康诺顿,谷氨酸参与斑马鱼视网膜OFF通路的机制。投资。角膜切削。粘度科学。, 2002年。43(12): p. E-abstract 1826。
98.金,h·g·米勒和r·f·米勒,泥虱视网膜光感受器到双极细胞的突触传递特性。J Neurophysiol, 1993。69(2): 352 - 60页。[PubMed]
99.费明格利蒂,小e.v.和H.科尔布,视网膜神经节细胞上中心和非中心反应的结构基础。科学,1976。194(4261): 193 - 5页。[PubMed]
One hundred.R·纳尔逊,小E.V.·费明列蒂和h·科尔布,细胞内染色显示猫视网膜上和非中心神经节细胞有不同程度的分层。j . Neurophysiol。, 1978年。41(2): 472 - 483页。[PubMed]
101.阿姆索尔,f.r., E.S.高桥,C.W.奥伊斯特,兔视网膜神经节细胞同心性感受野的形态。神经科学杂志,1989。280(1): 72 - 96页。[PubMed]
102.布卢姆菲尔德,S.A.和R.F.米勒,兔视网膜上ON和OFF通路的功能组织。J >, 1986。6(1): 1-13页。[PubMed]
103.Ammermüller, J.和H.科尔布,海龟内视网膜的组织。一、ON和off中心路径。神经科学杂志,1995。358(1): p猴。[PubMed]
104.科恩,e·p·斯特林,与β上神经节细胞接受野中心相关的微电路。J Neurophysiol, 1991。65(2): 352 - 9页。[PubMed]
105.科尔布、H。猫视网膜内丛状层:电子显微镜观察。J Neurocytol, 1979。8(3): 295 - 329页。[PubMed]
106.科尔布,H.和L.德科沃尔,人视网膜旁凹小神经节细胞:电子显微镜和序列切片重建的研究。神经科学杂志,1991。303(4): 617 - 36页。[PubMed]
107.科尔布,h·r·纳尔逊,猫视网膜off - α和off - β神经节细胞:2。HRP染色电镜显示的神经回路。神经科学杂志,1993。329(1): 85 - 110页。[PubMed]
108.麦奎尔,文学学士,j·k·史蒂文斯,p·斯特林,猫视网膜双极细胞的微电路。J >, 1984。4(12): 2920 - 38页。[PubMed]
109.纳尔逊,R.和H.科尔布,猫视网膜双极细胞和神经节细胞的突触模式和反应特性。视觉Res, 1983。23(10): 1183 - 95页。[PubMed]
110.Dumitrescu, O.N,等人,异位视网膜ON双极细胞突触在OFF内丛状层:接触多巴胺能无分泌细胞和黑视素神经节细胞。神经科学杂志,2009。517(2): 226 - 44页。
111.Grunert, U.等人,灵长类动物视网膜中含有神经节细胞的黑视素的双极输入。Vis >, 2011。28(1): 39-50页。
112.庞俊杰,高峰,吴绍明,背气孔视网膜双极细胞对光响应属性的逐层投射。杂志,2004年。558(Pt 1):第249-62页。
113.高希,k.k.,等人,小鼠视网膜中双极细胞的类型。神经科学杂志,2004。469(1): 70 - 82页。
114.达西,D.M.和B.B.李,灵长类动物视网膜上的“亮蓝”通路源自一种独特的双层神经节细胞类型。自然,1994年。367(6465): 731 - 5页。[PubMed]
115.Famiglietti, e.v., Jr. A. Kaneko和M. Tachibana,鲤鱼视网膜神经节细胞通路的神经元结构。科学,1977。198(4323): 1267 - 9页。[PubMed]
116.李,Y.N.和J.E.道林,斑马鱼视网膜双极细胞-光感受器连接的特异性。ARVO会议文摘,2010。51(5): 4125页。
117.李,Y.N,等,斑马鱼视网膜的双极细胞-光感受器连接。ARVO会议摘要,2011。52(6): 2573页。
118.斋藤,T.,等人,鲤鱼视网膜光受体-双极连接模式的再检验:HRP-EM和高尔基- em研究。神经科学杂志,1985。236(2): 141 - 60页。[PubMed]
119.科尔布,h·r·纳尔逊,猫视网膜的无分泌细胞。视觉Res, 1981。21(11): 1625 - 33页。
120.马里安尼、。猴子视网膜中的巨大双极细胞。解剖记录,1983年。206(2): 215 - 220页。
121.黄,K.Y, E.D.科恩,J.E.道林,巨鼠视网膜双极细胞输入机制。2双极细胞的膜片钳分析。J Neurophysiol, 2005。93(1): 94 - 107页。
122.卡哈尔,S。视网膜的结构在:Thorpe SA, Glickstein M,译者(1972)。1892年,斯普林菲尔德:托马斯。
123.达歇,R.F.和E.拉维奥拉,兔视网膜中的杆状通路:一个去极化的双极和无分泌细胞。J >, 1986。6(2): 331 - 45页。[PubMed]
124.de la Villa, P., T. Kurahashi和A. Kaneko,从猫分离的视网膜双极细胞的三种亚型中l -谷氨酸诱导反应和cgmp激活通道。J >, 1995。15(5 Pt 1):第3571-82页。[PubMed]
125.雪莉,D.M.和S. Yazulla,金鱼双极细胞和轴突末端模式:高尔基体研究。神经科学杂志,1993。329(2): 188 - 200页。[PubMed]
126.彭俊杰等,杆状细胞直接输入到锥状细胞,杆状细胞直接输入到锥状细胞,挑战了哺乳动物BC回路的传统观点。美国国家科学院学报,2010。107(1): 395 - 400页。
127.庞俊杰,高峰,吴绍明,暗适应小鼠视网膜中杆状双极细胞、锥体去极化双极细胞和所有无分泌细胞的光诱发电流响应。杂志,2004年。558(Pt 3)第897-912页。
128.Greferath, U. Grunert和H. Wässle,哺乳动物视网膜中的杆状双极细胞具有蛋白激酶c样免疫反应性。神经科学杂志,1990。301(3): 433 - 42页。[PubMed]
129.科尔布,H.张,L.德科沃尔,蛋白激酶C同工酶抗体对人视网膜神经元的差异染色。Vis >, 1993。10(2): 341 - 51页。[PubMed]
130.根岸,K., S.加藤,T.寺岸,一些脊椎动物视网膜中的多巴胺细胞和杆状双极细胞含有蛋白激酶c样免疫反应性。>, 1988。94(3): 247 - 52页。[PubMed]
131.科尔布,h·和e·v·费明列提,猫视网膜内丛状层的杆状和锥状通路。科学,1974。186(4158): 47-9页。[PubMed]
132.纳尔逊,R。所有的无分泌细胞都能加快猫视网膜中杆状信号的传递时间。J Neurophysiol, 1982。47(5): 928 - 47页。[PubMed]
133.米尔斯,S.L.和S.C.梅西,所有无分泌细胞的两个间隙连接通路的不同特性[见注释]。自然,1995年。377(6551): 734 - 7页。
134.Veruki M.L.和E. Hartveit,甲氯芬肟酸阻断视网膜全无分泌细胞和锥体上双极细胞的电突触。J Neurophysiol, 2009。101(5): 2339 - 47页。
135.科尔布、H。猫视网膜外丛状层的组织:电子显微镜观察。J Neurocytol, 1977。6(2): 131 - 53页。[PubMed]
136.纳尔逊,R。猫视锥细胞有杆状输入:猫视网膜视锥细胞和水平细胞体反应特性的比较。神经科学杂志,1977。172(1): 109 - 35页。[PubMed]
137.拉维奥拉,E.和N.B.吉鲁拉,脊椎动物视网膜中感光细胞之间的缝隙连接。美国国家科学院,1973。70(6): 1677 - 81页。[PubMed] [免费全文在PMC]
138.史密斯,r.g., M.A.弗里德,P.斯特林,暗适应猫视网膜的微电路:杆锥网络的功能结构。J >, 1986。6(12): 3505 - 17页。[PubMed]
139.冢本,Y.等人,小鼠视网膜夜视微电路。J >, 2001。21(21): 8616 - 23页。[PubMed]
140.Lasansky、。虎蝾螈幼体视网膜外突触层的组织。生物学杂志,1973。265(872): 471 - 89页。[PubMed]
141.斯特尔,w.k., A.T.石田,D.O.莱特福特,视网膜双极细胞中心上和中心外反应的结构基础。科学,1977。198(4323): 1269 - 71页。[PubMed]
142.哈克,I.和L.佩希尔,兔视网膜的水平细胞非选择性地与视锥细胞相连。神经科学杂志,1999。11(7): 2261 - 74页。
143.李、W、陈世盛和S.H.德弗里斯,在哺乳动物视网膜中的一种快速杆感光信号通路。Nat >, 2010。13(4): 414 - 6页。
144.冢本,Y.等人,mglur6缺陷小鼠视网膜异位代谢性谷氨酸受体7 (mGluR7)揭示了杆状细胞与ON锥双极细胞之间的新连接。J >, 2007。27(23): 6261 - 7页。
145.夏普,L.T.和a。斯托克曼杆状通道:什么都看不到的重要性。趋势>,1999。22(11): 497 - 504页。
146.副总统康诺顿和G.马奎尔,电压门控K的微分表达式+和Ca2 +斑马鱼视网膜切片中双极细胞的电流。神经科学杂志,1998。10(4): 1350 - 62页。[PubMed]
147.A.和H. Wässle,大鼠视网膜孤立棒状双极细胞的电压和发射器门控电流。J Neurophysiol, 1990。63(4): 860 - 76页。[PubMed]
148.拉萨特的话题,培养视网膜双极细胞的膜电流。J Neurophysiol, 1988。60(4): 1460 - 80页。[PubMed]
149.潘,胡振华,胡慧君,压敏娜+哺乳动物视网膜锥体双极细胞中的电流。J Neurophysiol, 2000。84(5): 2564 - 71页。[PubMed]
150.马友平,崔健,潘志华,电压依赖性钠的异质表达+和K+哺乳动物视网膜双极细胞中的通道。Vis >, 2005。22(2): 119 - 33页。
151.崔健,潘振华,两种锥体双极细胞在大鼠视网膜中表达电压门控的钠离子通道。Vis >, 2008。25(5 - 6): 635 - 45页。
152.泽尼塞克等人,电压依赖性钠离子通道在非突峰型视网膜双极神经元中表达。J >, 2001。21(13): 4543 - 50页。[PubMed]
153.普罗蒂,地方检察官和我。大鼠视网膜切片双极棒细胞的钙电流和钙信号。J >, 1998。18(10): 3715 - 24页。[PubMed]
154.泽尼塞克,D. G.马修斯,视网膜双极神经元的钙动作电位。Vis >, 1998。15(1): 69 - 75页。[PubMed]
155.海德尔伯格,r·g·马修斯,金鱼视网膜双极神经元单突触终末的钙内流和钙电流。杂志,1992年。447: p。235 - 56。[PubMed] [免费全文在PMC]
156.Kaneko, A.等人,金鱼和小鼠视网膜双极细胞的膜电流和药理学比较研究。生物化学学报,1991。98(1): 115 - 27页。[PubMed]
157.金子,L.H.平托,立花,小鼠视网膜双极细胞的瞬时钙电流。杂志,1989年。410: 613 - 29页。[PubMed] [免费全文在PMC]
158.马奎尔,G.等人,-氨基丁酸B型受体对虎蝾螈视网膜双极细胞末端l型钙通道电流的调节。美国科学院学报,1989。86(24): 10144 - 7页。[PubMed] [免费全文在PMC]
159.Kaneko, A.和M.立花,鲫鱼分离双极细胞膜电流的电压钳分析。杂志,1985年。358: 131 - 52页。[PubMed] [免费全文在PMC]
160.范,S.F.和s.a Yazulla,多巴胺损耗与6-OHDA增强多巴胺d1受体调节视网膜双极细胞钾电流。Vis >, 2001。18(2): 327 - 37页。[PubMed]
161.Tessier-Lavigne, M.等人,蝾螈视网膜双极细胞的膜电流。医学杂志,1988。91(1): 49 - 72页。[PubMed]
162.卡门曼斯,M.等人,视网膜外半通道介导的抑制。科学,2001。292(5519): 1178 - 80页。[PubMed]
163.Vardi, N.等人,视网膜神经元中不同的阳离子氯离子共转运体对氨基丁酸有相反的反应。J >, 2000。20.(20): 7657 - 63页。[PubMed]
164.托雷森,W.B.和R.F.米勒,兴奋性氨基酸激动剂在泥狗视网膜ON双极细胞中诱发的膜电流。J Neurophysiol, 1993。70(4): 1326 - 38页。[PubMed]
165.副总统康诺顿等人,斑马鱼视网膜兴奋性和抑制性神经递质的免疫细胞化学定位。Vis >, 1999。16(3): 483 - 90页。[PubMed]
166.弗利德,m.a., Y.中村,P.斯特林,猫视网膜中积累GABA的四种无分泌物。神经科学杂志,1983。219(3): 295 - 304页。[PubMed]
167.弗里德,m.a., R.G.史密斯,P.斯特林,猫视网膜中的杆状双极阵列:来自杆状细胞和积聚gaba的无分泌细胞的输入模式。神经科学杂志,1987。266(3): 445 - 55页。[PubMed]
168.Marc R.E.和W. Liu,视网膜中基本的gaba能无分泌细胞回路:嵌套反馈、串联抑制和轴体突触。神经科学杂志,2000。425(4): 560 - 82页。[PubMed]
169.马克,R.E等人,金鱼视网膜中的gaba能通路。神经科学杂志,1978。182(2): 221 - 44页。[PubMed]
170.普尔乔,R.G.和D.J.戈贝尔,猫视网膜中积累GABA激动剂的神经元亚群(3.H)muscimol:高尔基体和放射自显影联合研究。神经科学杂志,1983。219(1): 25 - 35页。[PubMed]
171.康诺顿,副总裁,r·尼尔森,还有A.M.弯曲机,GABA的电生理证据一个和GABAC斑马鱼视网膜双极细胞上的受体。Vis >, 2008。25(2): 139 - 53页。
172.Lukasiewicz, p.d., B.R. Maple和F.S. Werblin,虎蝾螈视网膜双极细胞末端的一种新的GABA受体。J >, 1994。14(3 Pt 1): 1202-12页。[PubMed]
173.立花,m.a Kaneko,-氨基丁酸对双极细胞轴突末端有局部抑制作用:来自无分泌细胞的负反馈证据。美国国家科学院,1987。84(10): 3501 - 5页。[PubMed] [免费全文在PMC]
174.立花,m.a Kaneko,视网膜双极细胞接受来自GABAergic无分泌细胞的负反馈输入。Vis >, 1988。1(3): 297 - 305页。[PubMed]
175.Lukasiewicz, P.D.和F.S. Werblin,一种新的GABA受体调节虎蝾螈视网膜双极细胞到神经节细胞和无分泌细胞的突触传递。J >, 1994。14(3 Pt 1):第1213-23页。[PubMed]
176.Burkhardt,地方检察官。栖木视网膜视锥细胞的反应与受体场组织。J Neurophysiol, 1977。40(1): 53 - 62页。[PubMed]
177.近藤,H.和J.丰田,氨基丁酸和甘氨酸对鲤鱼视网膜双极细胞的影响。视觉Res, 1983。23(11): 1259 - 64页。[PubMed]
178.伺服电动机,-氨基丁酸对虎蝾螈视网膜锥体和双极细胞的影响。大脑Res, 1986。365(1): 70 - 7页。[PubMed]
179.吴,S.M.和B.R. Maple,视网膜中的氨基酸神经递质:功能概述。视觉Res, 1998。38(10): 1371 - 84页。[PubMed]
180.Feigenspan, A. H. Wässle和J. Bormann,GABA受体Cl的药理学研究- - - - - -大鼠视网膜双极细胞的通道。自然,1993年。361(6408): 159 - 62页。
181.Lukasiewicz, P.D.和C.R. Shields,不同的GABA组合一个和GABAC受体赋予视网膜突触反应独特的时间特性。J Neurophysiol, 1998。79(6): 3157 - 67页。[PubMed]
182.Lukasiewicz, P.D.和C.R. Shields,视网膜中的GABA受体的多样性细胞发育生物学,1998。9(3): 293 - 9页。[PubMed]
183.Lukasiewicz, P.D.和R.O. Wong,伽马氨基丁酸C雪貂视网膜双极细胞受体:哺乳动物视网膜双极细胞亚型的多样性?Vis >, 1997。14(5): 989 - 94页。[PubMed]
184.麦克吉勒姆,下士,tc·罗托洛,R.F.达歇,兔视网膜切片中竿双极细胞的GABA反应。Vis >, 2000。17(3): 381 - 9页。[PubMed]
185.钱和J.E.道林,来自棒驱动的视网膜水平细胞的新的GABA反应。自然,1993年。361(6408): 162 - 4页。[PubMed]
186.钱和J.E.道林,伽马氨基丁酸一个和GABAC杂交鲈鱼视网膜双极细胞上的受体。J Neurophysiol, 1995。74(5): 1920 - 8页。[PubMed]
187.瓦奎罗,C.F.和p·德拉维拉,氨基丁酸的本地化C小鼠视网膜的杆状双极细胞轴突末端的受体。>, 1999。35(1): 1 - 7页。[PubMed]
188.Nelson, R,副总统Connaughton, A.E. Schaffner,急性游离斑马鱼视网膜神经元谷氨酸反应的电压探针测量。投资眼科视觉科学,1999。40: S242页。
189.艾格斯,ed, pd,卢卡谢维奇,伽马氨基丁酸一个,伽马氨基丁酸C甘氨酸受体介导的抑制对小鼠视网膜棒双极细胞的光诱发信号产生不同的影响。杂志,2006年。572(Pt 1): 215-25页。
190.海德尔伯格,r·g·马修斯,-氨基丁酸对单突触末端钙流入和钙电流的抑制作用。美国科学院学报,1991。88(16): 7135 - 9页。[PubMed] [免费全文在PMC]
191.艾格斯,ed, pd,卢卡谢维奇,受体和递质释放特性决定了视网膜抑制的时间进程。J >, 2006。26(37): 9413 - 25页。
192.弗拉姆克斯,T.E.和r·纳尔逊,GABA在猫视网膜中的功能作用:一。GABA的作用一个受体激动剂。Vis >, 1995。12(4): 641 - 50页。[PubMed]
193.弗拉姆克斯,t.e., r·纳尔逊,r·普弗拉格,GABA在猫视网膜中的功能作用:2。GABA的影响一个拮抗剂。Vis >, 1995。12(4): 651 - 61页。[PubMed]
194.释放,硕士。哺乳动物视网膜中的gaba能电路,在视网膜和中央视觉系统中的GABAbeplay体育公司.1992年,爱思唯尔:阿姆斯特丹。
195.张德清和杨小龙,鲤鱼视网膜中GABA(A)受体的激活可优先抑制OFF通路。大脑Res, 1997。759(1): 160 - 2页。
196.马修斯,G。s。阿尤布,r。海德尔伯格,氨基丁酸的突触前抑制作用是通过两种不同的氨基丁酸受体介导的,具有新的药理作用。J >, 1994。14(3 Pt 1): p. 1079-90。[PubMed]
197.麦克,A.F, ud。d。贝伦斯和h。j。瓦格纳,FM1-43观察金鱼Mb双极细胞末梢突触活性的抑制控制。Vis >, 2000。17(6): 823 - 9页。[PubMed]
198.庞俊杰,高峰,吴绍明,双极细胞和无分泌细胞输入对ON、OFF和ON-OFF视网膜神经节细胞光反应的相对贡献。视觉Res, 2002。42(1): 19-27页。[PubMed]
199.辛格,J.H.和J.S.戴蒙德,持续的Ca2 +进入视网膜带突触引起瞬时突触后电流。J >, 2003。23(34): 10923 - 33页。
200.查维兹,a。e。格兰姆斯,j。s。戴蒙德,大鼠视网膜中横向gaba能反馈到杆状双极细胞的机制。J >, 2010。30.(6): 2330 - 9页。
201.查维斯,a。e。j。h。辛格,j。s。戴蒙德,钙内流通过ampa型谷氨酸受体引发神经递质快速释放。自然,2006年。443(7112): 705 - 8页。
202.铃木,立bana,金子,甘氨酸和氨基丁酸对小鼠视网膜双极细胞的影响。杂志,1990年。421: 645 - 62页。[PubMed] [免费全文在PMC]
203.梅普尔,B.R.和S.M.吴,糖能突触输入到蝾螈视网膜的双极细胞。杂志,1998年。506 (Pt 3): 731 - 44页。[PubMed]
204.坎宁安,r·r·f·米勒,牛磺酸和甘氨酸对幼犬中视网膜神经元作用的电生理分析。即细胞内记录。大脑Res, 1980。197(1): 123 - 38页。[PubMed]
205.米特里勒先生,F. H. Wässle和T.沃伊特,猫视网膜中杆状通路的药理学调节。J Neurophysiol, 1988。59(6): 1657 - 72页。[PubMed]
206.普尔乔,R.G.和D.J.戈贝尔,高尔基体和放射自显像联合研究(3.H)猫视网膜内积累甘氨酸的无分泌细胞。神经科学杂志,1985。233(4): 473 - 80页。[PubMed]
207.Wässle, H., I. Schafer-Trenkler和T. Voigt,猫视网膜甘氨酸能抑制途径的分析。J >, 1986。6(2): 594 - 604页。[PubMed]
208.艾格斯,ed, pd,卢卡谢维奇,多种抑制途径形成视网膜的双极细胞反应。Vis >, 2011。28(1): 95 - 108页。
209.查韦斯,A.E.和J.S.戴蒙德,在大鼠视网膜中,甘氨酸能反馈传递到杆状双极细胞的机制多种多样。J >, 2008。28(31): 7919 - 28页。
210.杜,J.L.和X.L.杨,甘氨酸能突触向牛蛙视网膜双极细胞的传递具有输入特异性。神经科学,2002。113(4): 779 - 84页。[PubMed]
211.斯迈利,J.F.和S. Yazulla,红爪蟾视网膜外丛状层的甘氨酸能接触,以甘氨酸、氨基丁酸和甘氨酸受体抗体为特征。神经科学杂志,1990。299(3): 375 - 88页。[PubMed]
212.斯通,S. M.舒特,非洲爪蟾视网膜离中心和上中心双极细胞的生理和形态特性:甘氨酸和氨基丁酸的影响。Vis >, 1991。7(4): 363 - 76页。[PubMed]
213.海尔,W.A.和W.G.欧文,虎蝾螈视网膜双极细胞感受野的药理学研究。J Neurophysiol, 1996。76(3): 2005 - 19页。[PubMed]
214.Qian, H., et al.,小场和大场双极细胞对氨基丁酸和甘氨酸的反应。大脑Res, 2001。893(1 - 2): 273 - 7页。[PubMed]
215.梅里吉,拉维奥拉和达歇,兔视网膜内两种扁锥体双极细胞的连接。神经科学杂志,1996。371(1): 164 - 78页。[PubMed]
216.von Gersdorff, H.等人,视网膜双极神经元突触带上的囊泡可以迅速释放的证据。神经元,1996年。16(6): 1221 - 7页。[PubMed]
217.拉格纳多,L., A.戈米斯,C.约伯,视网膜双极细胞突触末端连续的囊泡循环。神经元,1996年。17(5): 957 - 67页。[PubMed]
218.泽尼塞克,J.A.斯泰尔和W.阿尔默斯,突触活性区单个囊泡的转运、捕获和胞外分泌。自然,2000年。406(6798): 849 - 54页。[PubMed]
219.道林,J.E视网膜:大脑中可接近的部分。1987年,剑桥(MA):哈佛大学出版社的贝尔纳普出版社。
220.道林,J.E.和B.B.联合抵制,灵长类动物视网膜的组织:电子显微镜。生物科学学报,1966。166(2): 80 - 111页。[PubMed]
221.米勒,r.f.,等人,蝾螈视网膜自发兴奋性突触后电流的突触前和突触后机制。大脑研究,2001年。131: 241 - 53页。
222.Wong-Riley M.T。,虎蝾螈视网膜内丛状层的突触组织。J Neurocytol, 1974。3.(1): 1-33页。
223.戈茨曼,J.和R.F.米勒,两栖动物视网膜神经节细胞上n -甲基- d -天冬氨酸受体的药理特性。J Neurophysiol, 1992。68(2): 596 - 604页。[PubMed]
224.海德尔伯格,r·g·马修斯,多巴胺提高Ca2 +视网膜双极神经元突触末梢的反应。Neuroreport, 1994年。5(6): 729 - 32页。
225.摩根,老温视网膜带状突触的神经递质释放。免疫细胞生物学杂志,2000。78(4): 442 - 6页。[PubMed]
226.von Gersdorff, H.和G. Matthews,突触末端内钙升高对内吞作用的抑制自然,1994年。370(6491): 652 - 5页。
227.内维斯,G., A. Neef和L. Lagnado,钡和锶对金鱼双极细胞突触末端胞吐和胞吞的作用。杂志,2001年。535(Pt 3):第809-24页。[PubMed]
228.锅,Z.HVoltage-activated Ca2 +哺乳动物视网膜双极细胞轴突末端的通道和向电离GABA受体。Vis >, 2001。18(2): 279 - 88页。
229.Burrone J.和L. Lagnado,视网膜双极细胞的突触抑制和胞吐动力学。J >, 2000。20.(2): 568 - 78页。[PubMed]
230.Mennerick S. G. Matthews,视网膜双极神经元突触末端钙电流引起的超快胞吐。神经元,1996年。17(6): 1241 - 9页。[PubMed]
231.von Gersdorff, H.和G. Matthews,带状突触末端囊泡池的耗竭和补充。J >, 1997。17(6): 1919 - 27页。[PubMed]
232.Rouze N.C.和E.A. Schwartz,囊泡在带状突触上的连续和短暂循环。J >, 1998。18(21): 8614 - 24页。[PubMed]
233.维卢基,m.l., S.H.莫克夫和E.哈特维特,大鼠视网膜上皮细胞中自发EPSCs和非nmda受体的功能特性。杂志,2003年。549(Pt 3):第759-74页。
234.辛格,j.h.,等人,哺乳动物带状突触的协调多泡释放。Nat >, 2004。7(8): 826 - 33页。
235.辛格,J.H.和J.S.戴蒙德,哺乳动物带状突触的囊泡损耗和突触抑制。J Neurophysiol, 2006。95(5): 3191 - 8页。
236.Pinto, L.H.,等,小鼠Grm6 nob4突变的产生、鉴定和功能表征。Vis >, 2007。24(1): 111 - 23页。[PubMed]
237.Takao, M.等人,代谢性谷氨酸受体6亚型缺陷小鼠的光行为抑制受损。神经科学,2000。97(4): 779 - 87页。[PubMed]
238.Thompson, S.等人,在小鼠瞳孔光反射和行为状态调节的辐照检测中,不同的视网膜内部通路介导杆-锥输入。投资眼科视觉科学,2011。52(1): 618 - 23页。[PubMed]
239.岩边,H.等人,mglur6缺陷小鼠的瞳孔反应障碍和视动性眼球震颤。神经药理学,1997年。36(2): 135 - 43页。[PubMed]
240.Tagawa, Y.等人,代谢性谷氨酸受体6亚型缺陷小鼠的免疫组织学研究未见视网膜细胞组织和神经节细胞成熟异常。J >, 1999。19(7): 2568 - 79页。[PubMed]
241.Berson, E.L.和S. Lessell,副肿瘤性夜盲症伴恶性黑色素瘤。眼科医生,1988年。106(3): 307 - 11页。[PubMed]
242.跑,H。回顾夜盲症:从人到分子。天天p演讲。投资眼科视觉科学,1982。23(5): 588 - 609页。[PubMed]
243.亚历山大,k.r.,等人,伴皮肤恶性黑色素瘤的副肿瘤性夜盲症的“On”反应缺陷。眼科科学,1992。33(3): 477 - 83页。[PubMed]
244.亚历山大,k.r.,等人,黑色素瘤相关视网膜病变的对比处理缺陷。投资眼科视觉科学,2004。45(1): 305 - 10页。
245.雷,B.,等,人黑素瘤相关视网膜病变(MAR)抗体在体内改变猴ERG的视网膜on反应。投资眼科视觉科学,2000。41(1): 262 - 6页。[PubMed]
246.丁格拉,A.等人,黑色素瘤相关视网膜病变中的自身抗体靶向视网膜ON双极细胞的TRPM1阳离子通道。J >, 2011。31(11): 3962 - 7页。
247.近藤,M.等人,与ON双极细胞功能障碍相关的副肿瘤视网膜病变患者中TRPM1自身抗体的鉴定。《公共科学图书馆•综合》,2011年版。6(5): p . e19911。
248.舒伯特,g。h。波恩沙因,【人体视网膜电图分析】。Ophthalmologica, 1952年。123(6): 396 - 413页。[PubMed]
249.古德曼,G.和H. Bornschein,先天性夜盲症与全色盲的视网膜电图比较研究。美国医学会眼科大师,1957年。58(2): 174 - 82页。[PubMed]
250.Miyake, Y.等人,先天性静止性夜盲症伴视网膜电图阴性。一个新的分类。角膜切削,1986年。104(7): 1013 - 20页。[PubMed]
251.宅一生,Y。,【新临床实体概念的建立——先天性静止性夜盲症完全性与不完全性形态】。日本Ganka Gakkai Zasshi, 2002。106(12): 737 - 55页;讨论756年。
252.Bech-Hansen, N.T,等人,编码富含亮氨酸的蛋白多糖夜盲症的NYX突变导致x连锁完全性先天性静止性夜盲症。Nat麝猫,2000年。26(3): 319 - 23页。[PubMed]
253.Bech-Hansen, N.T,等人,Xp11.23中钙通道α 1亚基基因失功能突变导致不完全x连锁先天性静止性夜盲症。Nat麝猫,1998年。19(3): 264 - 7页。[PubMed]
254.Zeitz, C.等人,GRM6突变导致常染色体隐性遗传先天性静止性夜盲症,伴有独特的暗斑15赫兹闪烁视网膜电图。投资眼科视觉科学,2005。46(11): 4328 - 35页。
255.席勒、泵房、视网膜ON和OFF通路的中央连接。自然,1982年。297(5867): 580 - 3页。[PubMed]
256.席勒、泵房、猴子的视网膜通路与外侧膝状核的连接。视觉Res, 1984。24(9): 923 - 32页。[PubMed]
257.纳普,A.G.和L.A. Mistler,兔外侧膝状核细胞在视网膜上中心通道可逆阻断过程中的响应特性。J Neurophysiol, 1983。50(5): 1236 - 45页。[PubMed]
258.克莱兰,b.g., M.W.杜宾和W.R.莱维克,猫视网膜和外侧膝状核的持续性和短暂性神经元。杂志,1971年。217(2): 473 - 96页。
259.多兰,R.P.和P.H.席勒,2-氨基-4-磷酸丁酸(APB) ON通道阻断对猴子亮度和对比度感知的影响。Vis >, 1994。11(1): 23-32页。[PubMed]
260.多兰,R.P.和P.H.席勒,灵长类动物视网膜中只有去极化的杆状双极细胞的证据。Vis >, 1989。2(5): 421 - 4页。[PubMed]
261.秦,P.和R.G. Pourcho,猫视网膜中ampa选择性谷氨酸受体亚基的定位:光镜和电子显微镜研究。Vis >, 1999。16(1): 169 - 77页。[PubMed]
最后更新:2012年2月29日。
关于作者
拉尔夫·尼尔森的生物简介可以在关于Webvision的编辑器部分.
维多利亚康诺顿博士。是位于华盛顿特区的美利坚大学生物学副教授。Vikki出生在宾夕法尼亚州的Sellersville,获得了学士学位巴克内尔大学和海洋科学博士学位特拉华大学刘易斯分校.她一直是博士后研究员德克萨斯大学休斯顿分校神经生物学和解剖学系,还有国立卫生研究院在那里她继续研究斑马鱼视网膜神经解剖学和神经生理学与合著者拉尔夫·纳尔逊.Connaughton博士目前的研究兴趣包括发育生物学(神经系统发育)和神经生物学的学科。具体来说,她对研究硬骨鱼幼虫的视觉引导行为与视网膜神经元、电路和受体机制成熟之间的关系很感兴趣。她还对研究突变或药物如何改变神经连接的发展感兴趣。她已经完成了解决行为/生态问题的实验,以及那些使用细胞生物学技术来检查正在发育和成人视网膜组织中的视网膜回路的实验。