伊多·帕尔曼,海尔加·科尔布和拉尔夫·纳尔逊
1.简介
水平细胞是脊椎动物视网膜末梢的中间神经元。它们为光感受器之间的局部和远距离相互作用提供了途径。这些相互作用被称为反馈信号。反馈信号调节光感受器突触输出的增益,在水平细胞本身和相邻的近端突出的双极细胞中都可以看到。在形成远端、外侧突触网络的过程中,水平细胞不仅丰富了自身的生理机能,也丰富了突触前和突触后伙伴的生理机能。它们在视锥细胞和双极细胞中产生空间竞争。它们也在视锥细胞、双极细胞和彩色水平细胞亚型中产生颜色对抗。水平细胞在视网膜中向前传播的行为,可以在视网膜神经节细胞的生理和视觉感知中被识别。水平细胞的活动反过来由其他视网膜神经元释放的神经调节剂调节。
2.历史
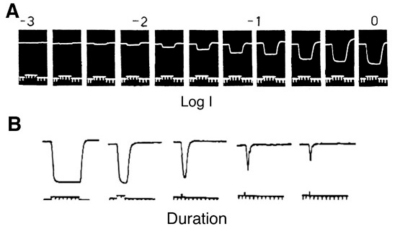
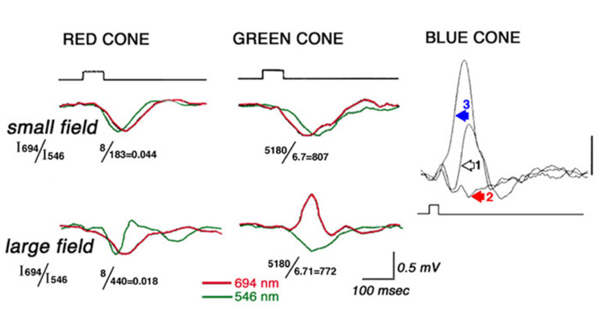
脊椎动物视网膜上记录的第一个细胞内光诱发反应是膜电位的缓慢、负的变化,只要光刺激存在就会持续(图1)。在这些反应的形态学来源变得清楚之前,它们被简单地称为s电位(1)。如图1所示,s电位是膜超极化,只要光刺激存在就会持续。s电位的分级特征在图1A中很明显。刺激越亮,s电位的振幅越大,直到达到饱和水平。在图1B中,为了检验s电位的时间特性,改变了固定强度光刺激的持续时间。对于长时间的刺激,s电位只在持续时间内发生变化,但振幅保持不变(图1B中最左边的两个响应)。刺激持续时间的进一步缩短导致振幅下降(图1B)。这说明了s势的时间累加,遵循布洛赫定律。在一定的刺激持续时间内,在这种情况下约为10毫秒,振幅与刺激的量子含量(量子通量乘以持续时间)直接相关,而对于持续时间较长的刺激,振幅与量子通量相关,即光感受器的量子吸收率(1)。在s电位中,这种“临界持续时间”随刺激条件的不同而有很大的变化(2)。Gunnar Svaetichin,尽管“缓慢的潜能”是另一种常见的解释。
当s电位首次被描述时,20世纪50年代的神经生理学家们感到困惑。当时,人们认为只有突触输入才会使神经元去极化(内部相对于外部变得更正),从而使其内部负的静息膜电位降低。这种去极化被认为是一种兴奋,如果这种兴奋足够大,就会产生动作电位或神经尖峰,将信号沿神经细胞轴突的长度传递下去。然而,s电位并没有被光去偏振,而是超偏振,即使在最亮的光刺激下也不会产生动作电位。
起初,s电位的细胞类型起源并不清楚,只知道微电极尖端位于视网膜外部的某处。事实上,Svaetichin最初认为s电位来自视锥细胞(1)。然而,后来的细胞内标记技术,将染料从电极尖端注入记录神经元的细胞质,揭示了水平细胞,即视锥突触后的二级神经元,是s电位的来源(3,4)。自从在鱼类视网膜中首次被描述以来,在所有脊椎动物的视网膜水平细胞中都记录了s电位。这些动物包括冷血脊椎动物(4-13)、家庭哺乳动物(14-20)和灵长类动物(21-26)。水平细胞现在已经被许多研究者使用解剖学、生化、药理学和电生理学技术进行了研究。在本章中,我们将尝试总结我们目前对脊椎动物视网膜水平细胞的知识。
点击此处观看脊椎动物视网膜水平细胞内记录的电影(117 K quicktime电影)
3.形态和电路。
水平细胞是直接与光感受器接触的二级神经元,遍及视网膜的外丛状层平面。这些细胞类型最初被描述为巨大的砖状结构,占据了鱼视网膜内核层的大部分(27,28)。早期的解释认为这些细胞是神经胶质细胞,主要是因为它们对光产生超偏光的慢反应(s电位),而不是像“真正的神经元”那样产生去偏光峰值。现在我们知道水平细胞是真正的神经元,它们产生真正的,如果唯一的突触,并表现出神经元的大多数结构和超微结构特征。通过高尔基染色、细胞内标记和免疫染色技术,我们了解到水平细胞可以适应不同脊椎动物视网膜的各种形态(6,29 -44)。
水平电池的选择性杆和锥接触
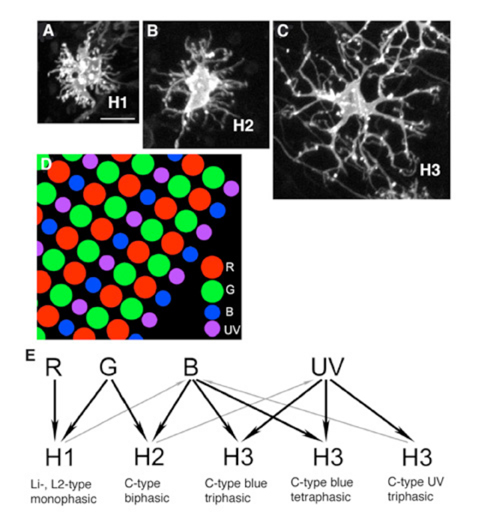
大多数陆生脊椎动物视网膜的水平细胞有两种形态类型,具有轴突的b型细胞和无轴突的a型细胞(图2a)。在哺乳动物中,B型和a型细胞的树突接触锥细胞,而B型细胞的轴突末端接触杆细胞(灰色区域,图1A)。在鸟类和爬行动物中,水平细胞有进一步的无轴突亚型,具有颜色特异性的锥体连接(图2a,无轴突)。图2a显示了不同物种中这些不同类型水平细胞的形态。还显示了与每种类型连接的锥的光谱类型(红、蓝、绿点)。
在鱼视网膜中,短轴突或无轴突水平细胞(H4型)只接触杆状细胞(45,46),而所有轴突承载细胞的树突只接触锥状细胞(图2b)。鱼水平细胞的轴突不接触感光细胞。鱼体内有多种轴突承载、锥接触、水平的细胞(H1、H2、H3),每种细胞具有不同的锥选择性模式。在斑马鱼的例子中(图2b),大多数被4种锥类型中的2种所激发,并避免来自其他类型的兴奋输入。唯一的例外是H3 UV三相型,它似乎是由UV或蓝色锥体选择性激发的。H2型和H3型在波长生理上是色敌,H1型不是。
哺乳动物和爬行动物的b型水平细胞编码亮度变化,但不区分颜色。它们调节锥细胞和双极细胞的适应性和空间反应。这些是光度型水平细胞,其生理学将在后面讨论。这些b型细胞通常可以用抗钙结合蛋白(47-49)的抗体识别,有些含有神经递质GABA(47,50,51)。在海龟视网膜中,乙酰胆碱位于H1型水平细胞树突中,它们在那里凹陷锥体蒂(47)。海龟的H1型细胞在形态学上类似于哺乳动物的b型细胞。哺乳动物视网膜b型水平细胞的树突是浓密的,并接触树突场内的所有视锥细胞。轴突从这些树突中产生。在它的远端,一个轴突末端萌发,从距离锥接触的树突场一定距离的大量杆状细胞中收集信号。轴突的长度和厚度被认为是电分离细胞的一部分与另一部分,因此,将细胞的锥体光感受器参与的室室与杆状光感受器参与的室室分离(17)。 In species where there are few rods (Fig. 2a, turtle) the B-type axon terminal makes sparse contacts with both red cones and the few rods present in this retina (36, 52). Nonetheless soma-dendritic and axon terminal compartments maintain physiological separation, as evidenced by different summation areas (53). The type I horizontal cell of pigeon retina is axon bearing and also appears analogous to mammalian B-type cells. Similar to turtle, the axon terminal contacts a mixture of rods and cones, while the dendrites contact cones (35).
哺乳动物的a型水平细胞是纯锥连接的(大多数物种只有绿色和蓝色的锥)。它们与杆状光感受器完全没有联系。三色灵长类动物(人类和东半球猴子)视网膜的H2细胞是一种a型细胞。即使H2细胞,一个或多个树突被拉长和轴突样,也只接触球果。有趣的是,这些较长的树突主要接触蓝色球果。这可能是哺乳动物无轴突水平细胞的一个普遍主题,只是现在才被认识到。在某些大型猫科动物中(在家猫中尚未证实),a型细胞的细长树突尖端接触蓝色锥,而更靠近细胞体的树突同时接触红色锥和蓝色锥(54)。在马的a型细胞显然只连接到蓝色锥细胞(图2a)(38,40)。
在具有良好色觉的爬行动物和鸟类中,通常有两种无轴突水平细胞类型。每一个都有选择地与锥型连接。在龟、鸟和鱼这些具有良好色觉的物种中,H2型和H3型水平细胞是大的星状细胞。在鸟类和海龟中,这些细胞没有轴突,但在鱼类中,H2和H3是轴突。这些细胞有选择地接触视锥细胞并感知颜色(图2a,无轴突,颜色对抗类型的鸟类和爬行动物;图2b、H2、H3鱼类轴突承载类型)。H2和H3对部分波长有超极化反应,对其他波长有去极化反应。因此,在海龟(五色视物)和鱼(三色视物或四色视物)中,H2水平细胞连接到绿色和蓝色视物,H3连接到蓝色视物(图2a,图2b),或连接到蓝色视物和紫外线视物(6,7,36,37,41,43,52,55,56)。在海龟和斑马鱼中,对紫外线敏感的视锥细胞似乎只与H3型水平细胞相连,与蓝色视锥细胞共享这种类型。免疫组化可识别出部分彩色水平细胞。 The C-type horizontal cells of the turtle can be labeled with antibodies to nitric oxide synthase and calcium binding proteins (47); the former suggests a role for NO in their functioning (see section on Neuromodulation).
水平细胞总是在光感受器带突触后的“横向元件”上与光感受器终端相互作用(图3a,左,箭头)。在鱼的视网膜中,水平细胞与外侧单元的视锥的连接以称为小刺的微小突出物为特征(图3b)。小刺是动态的,形状随光照水平的变化而变化。棘突的形成受到背景照明的刺激,而黑暗则会引起回缩(57,58)。已知这些塑料小刺含有钙结合蛋白caldendrin和CaMKII(59)。小刺受内源性昼夜节律控制,但需要大脑通过作用于视网膜中的多巴胺能丛状细胞系统的fmr -酰胺样和gnrh样激素释放激素(60,61)进行离心控制(62,63)。这些小刺似乎也受视觉周期副产物视黄酸的局部控制(64,65)。
间隙结触点和连接物
所有物种的视网膜水平细胞都通过缝隙连接区与同源相邻细胞相互连接。它们发生在树突之间,轴突末端之间,偶尔也发生在树突和细胞体之间。间隙连接具有很强的选择性,只发生在相同类型的细胞之间(即H1到H1等)。这种排他性甚至延伸到b型水平细胞的轴突末端区域和树突区域,即间隙连接连接树突与树突,连接轴突末端与轴突末端,但不连接轴突末端与树突(66,67)。缝隙连接可以非常大,表现为斑块(图3c)。首先由Yamada和Ishikawa(28)在鱼的视网膜中描述,缝隙连接被认为是专门用于电传输的“融合膜结构”。Kaneko(66)注意到黄色染料在形态相似的水平细胞之间扩散,并指出电连接可以让小分子自由地通过所谓的水平细胞的s空间(10)。
从两个水平的细胞突起在紧密相对的质膜(2-4 nm间隙)上形成间隙连接(图3c)。每个相互作用的细胞提供连接子或半通道以完成间隙结接触。这些通道可以由同质体或异质体连接蛋白亚基组成,因此,可能允许在不同神经元之间存在各种各样的具有轻微不同性质的间隙连接。每个连接蛋白通道包含6个连接蛋白(Cx)包围着通道孔。在鱼和龟的视网膜中,Cx43和Cx26最初被认为包含水平细胞间隙连接蛋白(68,69)。然而,最近已经证实连接蛋白57在蛋白质水平上表达,并介导小鼠b型水平细胞之间的树突间隙连接。连接的数量似乎随着光的适应而增加(70)。在兔视网膜的一项研究中,与小鼠不同的是,a型和b型水平细胞都存在,O 'Brien及其同事发现Cx50是a型水平细胞树突之间的连接蛋白(71)。在斑马鱼中表达了多种连接蛋白,特别是参与树突-树突连接的Cx52.6(图3e)和在横向元件与锥形成半间隙连接通道的Cx55.5(图3d)(72)。在Cx55.5基因敲除的斑马鱼中,水平细胞的颜色对手降低了(73)。 This connexin is important for feedback modulation of cone synapses. In addition to Cx55.5, another connexin (52.9) is also expressed in zebrafish horizontal cells. It is found both in lateral elements where it may participate in feedback, and in gap junctions between horizontal cell dendrites within the outer plexiform layer (73). Horizontal cell gap junctions pass not only ions but small cytoplasmic molecules and tracer dyes of less than 500 Dalton size (74). Gap junctions enlarge horizontal cell receptive fields (see section on gap junction physiology), and are modulated by retinal neurotransmitters or humoral factors (see section on neuromodulation).
4.生理类型。
脊椎动物的视网膜包含了一组镶嵌的杆状和锥状感光体,分别用于适应黑暗和光明的视觉。多种锥体类型,每一种都有选择地表达一种视觉色素,调节到可见光谱的特定区域,为脊椎动物提供了辨别颜色的机会。锥型由其视觉色素的光谱偏好来定义;例如,短波(SW)锥、中波长(MW)锥和长波长(LW)锥,分别称为蓝色/紫外线锥、绿色锥和红色锥。大多数哺乳动物是二色视者(两种锥体类型);然而,东半球的猴子和人类是三色视者(3种不同的锥体类型),许多非哺乳动物物种也是三色视者甚至四色视者(4种不同的锥体类型)。在鸟类、鱼类和爬行动物的视网膜中,除了LW、MW和典型的SW视锥(分别为红色、绿色和蓝色视锥)外,还可以发现一类对紫外线敏感的SW视锥(UV视锥)(27,75 -79)。由于不同光谱类型的杆和锥直接连接到水平细胞,探索水平细胞如何整合和处理这种丰富的光谱信息是很有意义的。
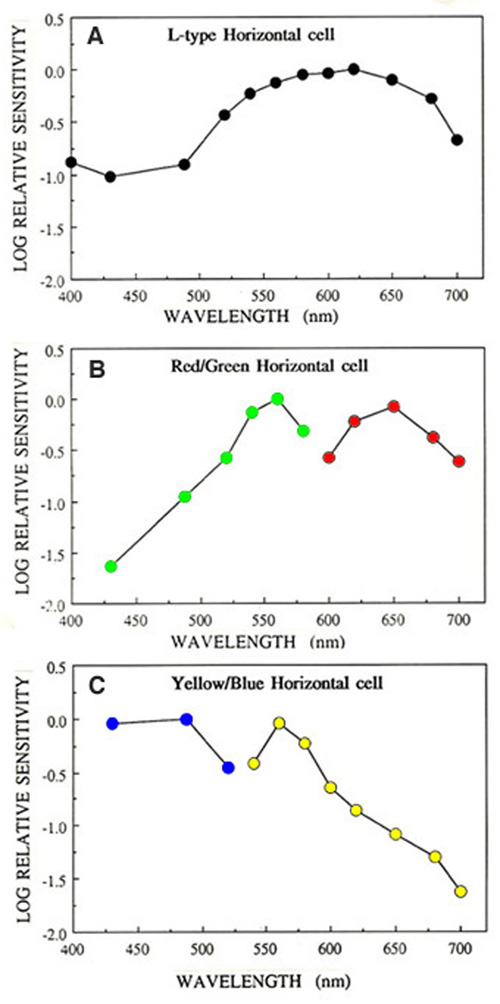
生理学家认为水平细胞有两种主要类型:光度和色度。这些可以通过对不同波长光的光响应来区分。光度(l型)水平细胞对光谱可见范围内的任何波长的光刺激都具有超偏振反应,而色度(c型)水平细胞对不同波长的光刺激具有不同的极性反应(80)。
l型水平细胞
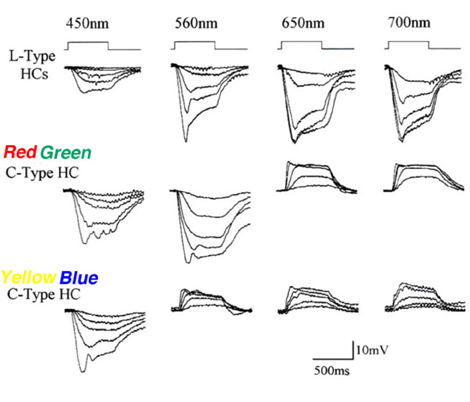
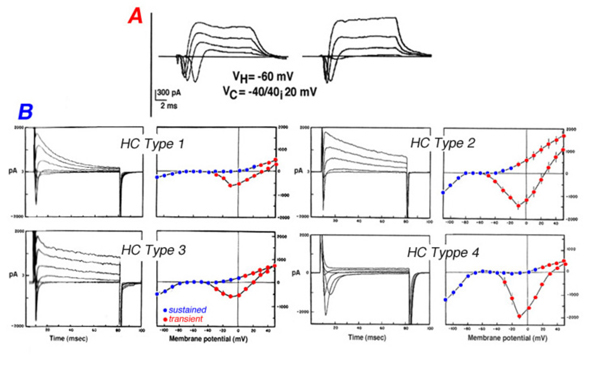
光(l型)水平细胞存在于所有被研究过的视网膜中,包括非哺乳动物脊椎动物、哺乳动物和灵长类动物。图4显示了蟾蜍(A)、兔(B)和猴(C)视网膜的光度型水平细胞的光响应。不管波长是什么,这些细胞的膜超极化反应只取决于刺激的亮度和持续时间。在某些物种中,l型水平细胞可从解剖结构和生理特性上区分为两类。在海龟视网膜中,L1和L2类型在光谱灵敏度上相似,但在感受野大小和对红光和绿光的光响应动力学上不同(53,81)。解剖学上,这两种l型水平细胞生理形态分别是海龟H1水平细胞的轴突末端和体细胞体(图2a)。
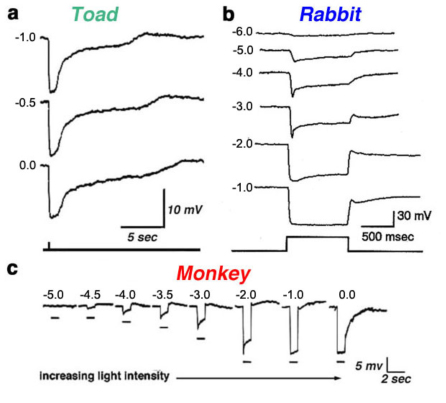 图4。蟾蜍、兔和猴视网膜光度型水平细胞的光响应记录。在每种情况下,光反应都是由不同强度的光刺激引起的。刺激强度以对数单位给出,相对于特定记录系统可用的最强烈的刺激。的插图一个来自诺曼和波乔布拉兹基,1976 (295);在b布卢姆菲尔德,1992(296),在c来自Dacheux和Raviola, 1990(23)。
图4。蟾蜍、兔和猴视网膜光度型水平细胞的光响应记录。在每种情况下,光反应都是由不同强度的光刺激引起的。刺激强度以对数单位给出,相对于特定记录系统可用的最强烈的刺激。的插图一个来自诺曼和波乔布拉兹基,1976 (295);在b布卢姆菲尔德,1992(296),在c来自Dacheux和Raviola, 1990(23)。
在猫和兔的视网膜中,a型和b型细胞(图2a)都是发光型。它们的形态和与杆状细胞和锥状细胞的连通性不同,但只对光刺激产生超偏光反应(14,15,17)。A型和b型光谱性质的差异尚未报道。和海龟的视网膜一样,鲤类和东半球猴子的视网膜也有红色和绿色的视锥细胞。在这些物种中,一些l型水平细胞喜欢绿色锥信号,而另一些则喜欢红色锥信号。在鲤类中,前者被称为L1型,后者被称为L2型(82)。在旧世界灵长类动物中,支持l型信号的红色和绿色都来自H1形态类型。H1细胞的红锥和绿锥信号的平衡分布,而不是两种离散类型(21,24)。在斑马鱼中,H1细胞上也有红绿平衡分布,产生极端的L1绿色峰值类型和L2红色峰值类型(6)。
图6。甲鱼视网膜中l型水平细胞、红/绿c型水平细胞和黄/蓝c型水平细胞光响应的波长依赖性对于每个波长,有几个强度嵌套。插图来自Twig等人,2003(92)。
c型水平细胞
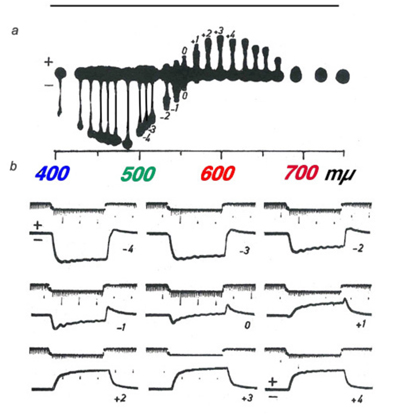
1959年,Svaetichin和MacNichol(80)首次报道了某些s -势的高度波长依赖性(图5)。如图所示,在约560 nm波长处,该s -势的光响应极性发生逆转。波长较长的光刺激使细胞膜去极化,波长较短的光刺激使细胞膜超极化。Svaetichin和MacNichol将这些“颜色对手”称为s单元色度或c型水平细胞。c型水平细胞在海龟、两栖动物和鱼类的视网膜中已被广泛研究(7,9,55,83 -94)。水平单元是根据响应极性反转的波长数量命名的;无逆转-单相(或l型)细胞,一个逆转-双相c型细胞,两个逆转-三相c型细胞,三个逆转-四相c型细胞。响应极性反转的波长称为“零波长”。在鱼视网膜中,已经描述了三种色度水平细胞;双相,三相和四相(6,86,95,96)。在弓鳍视网膜中,双相细胞的零波长在640 nm左右,而三相细胞的零波长在640 nm左右; in the regions of 500-530 nm and 650-670 nm respectively (95). The biphasic and triphasic C-type horizontal cells of the fish retina are identified morphologically as H2 and H3 types respectively (Fig. 2b). In zebrafish the H3 morphological type has taken on as many as 3 physiological identities: the blue triphasic, analogous to previous findings in fish, a UV triphasic type, and a tetraphasic type (6).
在海龟视网膜中,已经发现了两类双相c型水平细胞(7,85,91)。图6显示了甲鱼l型和c型水平细胞对不同波长和强度光刺激的典型光响应。对于每个波长,显示了对不同强度的一系列光响应。l型水平细胞(图6中第一行)对所有刺激都有梯度超极化反应,而不考虑波长。红/绿双相c型水平细胞(图6第二排)对红光刺激有分级去极化反应,对黄、绿、蓝刺激有分级超极化反应。黄/蓝双相水平细胞(第3行,图6)对红光和黄光刺激有去极化反应,对蓝光刺激有超极化反应。
为了确定水平细胞的光谱特性,使用微弱强度的单色光刺激来引起小振幅(<1mV)的光响应。这些光响应在细胞的线性范围内,可以用来计算光灵敏度。灵敏度被定义为每量子光的诱发响应的伏特,通过将电压响应除以刺激中的量子数来计算。光敏度与波长的关系就是细胞的作用光谱,描述了阈值光谱特性。图7显示了8个l型、7个红/绿型和6个黄/蓝型水平细胞的平均作用光谱(一个,B而且C(分别为毛remys caspica)。这些光谱清楚地表明,l型水平细胞对长波长刺激最敏感,主要兴奋性输入来自红色视锥细胞(7,85)。这些细胞从绿色视锥细胞和蓝色视锥细胞获得额外的兴奋输入(85)。红色/绿色c型水平细胞的特征是在600 nm左右的响应极性反转(图7)B).这些细胞被绿色和蓝色视锥细胞激活,被红色视锥细胞抑制(7,85)。黄/蓝c型水平细胞被绿色和红色锥细胞抑制,被蓝色锥细胞激活(7,85),有趣的是,也被UV锥细胞激活(27,97)。它们的光响应在540 nm左右极性相反(图7C)。
三相色反应在海龟水平细胞中很少报道(94),但在一些鲤类视网膜中很常见,甚至出现四相色反应(6,86,95,96)。这些物种在第一个光感受器后突触上处理光谱信息的能力是非常惊人的。斑马鱼视网膜中有六种光谱结构(6)。其中最复杂的是四视反应,在光谱中有三个零点。它被紫外光去偏振,被蓝色超偏振,被蓝绿色去偏振,被黄色和红色超偏振(图8A)。光谱分析表明,四相型的斑马鱼被绿色和紫外线锥去极化,被红色和蓝色锥超极化(6)。和其他鱼类一样(95),斑马鱼也有三相反应,但有两种类型,一种主要被紫外线锥超极化(图8B),另一种主要被蓝色锥超极化(图8C)。这两种三相细胞在中波长(绿色锥)刺激下去极化,在长波长(红色锥)刺激下超极化。斑马鱼的双相细胞(图8D)被长波(红色锥)去极化,被中短波(蓝色和绿色锥)超极化(6)。斑马鱼的l型水平细胞(图8E, 8F)被红色和绿色锥的输入超极化,但很少受蓝色锥和UV锥信号的影响。当不同波长的响应振幅通过考虑斑马鱼锥体色素形状的光谱模型拟合时(6,98),对蓝色和紫外线刺激的l型响应(图8E, 8F)显示为对红色和绿色锥体的短波吸收分支的刺激所产生的。L1型表现出红色和绿色锥体信号的平衡,L2细胞对红色锥体刺激的反应主要是超极化(6)。
哺乳动物缺乏c型水平细胞
鉴于低等脊椎动物水平细胞生理学的多样性,树突状细胞与含有不同视觉色素的视锥接触经常产生颜色上的对立反应,令人惊讶的是,在哺乳动物视网膜中,其水平细胞树突状细胞也接触含有不同视觉色素的视锥,但只能记录到光度型水平细胞反应(18,19,22,99,100)。例如,cat A-和B-水平细胞都是光度类型(图9),主要由红色锥输入,尽管使用特定的光谱刺激和适应条件可以检测到来自蓝色锥的低水平协同输入(100)。在A型和B型细胞中,杆状信号(图9)与锥状信号混合(16,17)。
哺乳动物水平细胞的颜色对抗性的失败可能与水平细胞的缺乏有关,以避免与长波长锥体的接触。斑马鱼视网膜的双相反应被认为是由H2型水平细胞产生的,该细胞避免接触红色视锥,而选择性接触绿色、蓝色和紫外线视锥。兴奋性输入来自蓝色和绿色锥体接触,红色抑制输入来自红锥体为主的l型水平细胞H1到蓝色锥体的反馈接触(图2b, E图)。在H2细胞中,没有红色超极化信号来掩盖H1到蓝色锥体的红色抑制反馈。这允许H2细胞显示颜色对手反馈信号(37)。
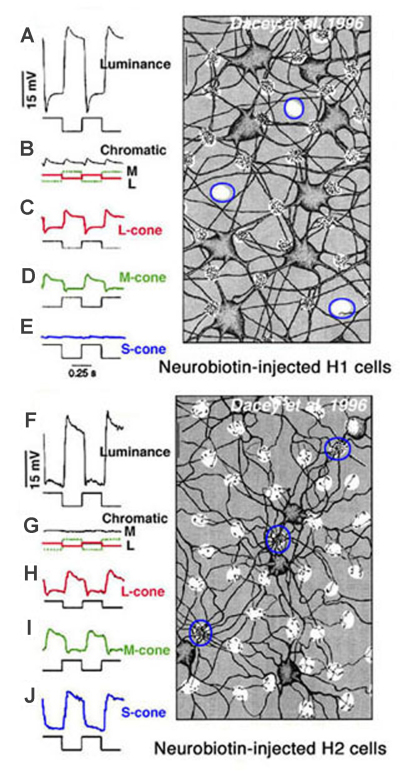
在灵长类动物的视网膜中,尽管有完整的红色、绿色和蓝色锥体类型,水平细胞也只出现为发光类型(22,23)。H1细胞从中长波长视锥(红色和绿色视锥)接收协同信号,而H2细胞从所有三种光谱类型的视锥接收协同输入;长、中、短波(红色、绿色和蓝色锥)如图10所示。从解剖学上看,H1型水平细胞倾向于避开蓝锥的蒂(图10,神经生物素注射的H1细胞)(22,101),因此对蓝锥隔离刺激不敏感(图10E)。另一方面,大量的H2树突接触蓝色锥蒂(图10,神经生物素注射的H2细胞,有轮廓的簇)(22,101,102)。H2细胞确实对光谱的蓝色端非常敏感(图10J)。然而,两种水平细胞类型的响应仅对所有波长具有超极化极性(22)。因此,哺乳动物和灵长类动物的l型水平细胞子集似乎主要致力于处理红绿蓝信号或红绿信号,但光谱对抗不是处理机制的一部分。
5.杆和锥的贡献和无源电气模型。
杆和锥信号的混合
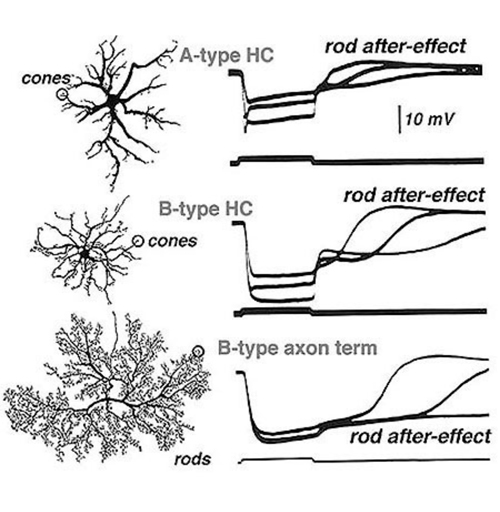
Steinberg(19,99)是第一个从哺乳动物视网膜上区分s电位中独立的杆状和锥状信号的人。他对猫视网膜的水平细胞进行了细胞内记录,看到了典型的分级超偏振反应,这取决于光刺激的强度。然而,与在非哺乳动物视网膜中看到的反应不同,斯坦伯格的s电位记录揭示了更明显的杆状和锥状反应。光刺激终止后看到的膜复极非常缓慢的阶段被确定为棒的贡献。Steinberg将其称为“杆后效应”(图9)。杆和锥信号成分的偏移动力学差异提供了一种方便的分析方法,可以将杆和锥输入分离到杆占主导的哺乳动物视网膜的s电位(16)。在图9中,显示了猫所有三种水平细胞结构的典型混合杆状和锥状信号(17)。在A型和b型水平细胞体中,杆状信号和锥状信号的振幅基本相等,而在b型细胞的轴突末端则出现杆状信号缓慢恢复的响应特性。这被解释为表明在猫的水平细胞体中杆状信号和锥状信号几乎相同地混合,但只有杆状信号在轴突终末可见。在强光刺激下,“杆后效应”会越来越长(图9,底部)。
进一步的证据表明,在光适应过程中,cat水平细胞的杆和锥输入混合。当视网膜被稳定的背景光所适应时,杆信号饱和,杆对水平细胞光响应的贡献,包括杆的后效,消失了。相比之下,视锥细胞适应了更明亮的环境,它们的输入保持稳健。杆状和锥状输入的这些特性很容易在哺乳动物水平细胞(如猫和兔子)的光反应中看到(15,17,19)。以杆为主的b型水平细胞轴突末端的光响应几乎被光适应所消除。在接收混合杆和锥输入的水平胞体(A和B类型)中,光适应选择性地减少了杆的贡献,但大的锥信号仍然存在,因此,这些水平胞体元素在背景光的存在下继续响应良好(16)。
猫体内携带轴突的b型水平细胞的轴突末端只接受来自杆状细胞的兴奋性前馈输入,而a型和b型细胞的细胞体只接触锥状细胞。那么猫水平细胞体中s电位的大棒状成分来自哪里呢?电子显微镜观察显示,在哺乳动物的外网状层中存在连接杆和锥感光器的缝隙连接(103,104)。这些电突触将杆状信号引入视锥细胞,进而进入水平细胞。这种光感受器中的杆/锥混合现在被认为是杆驱动的输入传递到水平细胞和视网膜中所有随后的二级和三级细胞的途径之一(105-108)。
在其他物种中,在水平细胞中可以发现类似的杆锥混合特征。在兔视网膜和猫视网膜中,以杆为主的轴突末端输入通过波形、灵敏度和后电位的存在来识别(15,109)。同样在灵长类动物视网膜中,携带轴突的h1型水平细胞的轴突末端产生杆状信号,而细胞体产生锥状信号或杆锥混合信号(22,23,26)。类似于其他哺乳动物的视网膜,灵长类动物h1型水平细胞的体细胞通过视杆和视锥之间的缝隙连接间接接收杆状输入(26)。
爬行动物和两栖动物的水平细胞,如哺乳动物,混合杆状和锥状信号。在蛇形龟的视网膜中,H1轴突末端的光响应包含缓慢的低振幅成分,由杆状光感受器贡献,尽管主要的兴奋输入来自长波长敏感的视锥细胞。同一H1水平细胞的细胞体只接受来自长、中波长敏感视锥的输入(110)。在非洲爪蟾中,水平细胞树突既接触杆状细胞也接触锥体细胞(111)。与哺乳动物相似,在光刺激下,这些细胞中记录了杆状细胞和锥状细胞的波形特征,包括杆状细胞的后效(112)。两栖动物的神经回路与哺乳动物的不同之处在于,两栖动物的神经回路与水平细胞树突直接接触,而哺乳动物的神经回路只与锥细胞接触,而杆状信号直接通过缝隙连接进入锥细胞。在鱼的纯锥接触水平细胞中没有杆状信号的报道(图2b,图8)。在鱼的杆状信号仅限于H4,一种特殊的杆状连接水平细胞类型(45,46)。
被动的电气模型
所有脊椎动物的视网膜都包含至少一种水平细胞类型,即轴突细胞(图2a,b型).这些水平细胞类型的轴突末端和体体由细长的轴突连接,但在许多情况下,每一端都表现为一个孤立的生理单元。在秀丽隐杆龟(Pseudemys scripta elegans)中,轴突末端和体体主要从红色锥体接收兴奋性输入,但在空间性质和对红色和绿色刺激的反应动力学上存在差异(53,81)。在另一种龟类Chelydra serpentina中,当细胞体树突接触红色和绿色球果时,轴突末端接受来自红色球果和杆的兴奋输入(110)。在家养哺乳动物(猫、兔)和灵长类动物(猴子)中,细胞体的树突接受来自视锥细胞的输入,而轴突的末端接触数以千计的杆状细胞。没有证据表明在这些情况下,轴突末端和同一细胞的体细胞体之间存在任何突触或电相互作用。
水平型细胞的树突部分离轴突末端很远(图2a,b型),基于神经元的解剖尺寸和几何形状,以及细胞膜和细胞质的欧姆线性特性的计算表明,轴突太长太薄,无法允许信号从细胞的一端到另一端进行显著的被动电紧张传播(17,26,36,110)。这些模型告诉我们,水平细胞的细胞体和轴突末端的信号只反映局部的突触输入。事实上,同一个细胞的两个部分是独立的单元(17),这显然违背了神经元理论。
在鱼体内,细胞体和轴突末端之间的这种生理分离规律似乎是一个例外。这些细胞中轴突末端的锥响应与细胞体相似(3)。由于鱼的轴突末端之间没有锥接触,信号很可能是从细胞体被动传递的。简单的无分支轴突终端的高阻抗可能允许信号通过轴突进行无源传播。
6.离子电导。
Ionotropic glutamate-gated渠道
光感受器通过信号保存突触激活水平细胞。在黑暗中,光感受器持续释放兴奋性神经递质,打开水平细胞阳离子通道,具有去极化反转电位。因此,水平细胞在黑暗中保持相对去极化电位。当光感受器在光刺激下超偏光时,神经递质释放减少,突触后配体门控通道关闭,水平细胞超偏光。光感受器末端的神经递质释放依赖钙。将视网膜暴露在通过电压依赖性钙通道干扰钙流入的离子中,会阻止光感受器释放神经递质,从而导致水平细胞超极化(113-115)。
对完整视网膜的早期实验表明,兴奋性氨基酸l -谷氨酸和l -天冬氨酸可能是光感受器神经递质的候选者(116-120)。将视网膜暴露于l -谷氨酸或l -天冬氨酸会导致水平细胞去极化并失去光响应,如图11A所示,在完整的兔视网膜中水平细胞(116)。这些观察结果与下述观点一致:在黑暗中,光感受器会持续释放兴奋性氨基酸,而水平细胞的光诱导超极化反应了突触间隙对氨基酸的再摄取。因此,外源应用的神经递质饱和水平细胞的受体位置,造成进一步的去极化。因为水平细胞被饱和了前女友原发应用神经递质,调节结束光刺激的源性递质释放对膜电位影响不大,光响应被消除。在图11A所示的实验中,需要含有15 mM l -天冬氨酸或l -谷氨酸的溶液诱导兔水平细胞去极化和光响应的丧失。这些和其他研究提出了两个主要问题。(1)为什么需要相对高浓度(在毫摩尔范围内)的兴奋性氨基酸来发挥图11A所示的作用?(2)两种兴奋性氨基酸中哪一种是光感受器神经递质?
 图11。一个.l -天冬氨酸和l -谷氨酸可使完整兔视网膜的水平细胞膜电位去极化,并消除水平细胞的光响应。这些光反应是由漫射光刺激引起的。插图来自Bloomfield和Dowling, 1985(116)。B.l -谷氨酸能使从鲤鱼视网膜分离的水平细胞的膜电位去极化,而l -天冬氨酸和d -谷氨酸则没有作用。每只吸液管装500µM的药物。电流脉冲测量膜电阻的变化。插图来自Lasater和Dowling, 1982(125)。
图11。一个.l -天冬氨酸和l -谷氨酸可使完整兔视网膜的水平细胞膜电位去极化,并消除水平细胞的光响应。这些光反应是由漫射光刺激引起的。插图来自Bloomfield和Dowling, 1985(116)。B.l -谷氨酸能使从鲤鱼视网膜分离的水平细胞的膜电位去极化,而l -天冬氨酸和d -谷氨酸则没有作用。每只吸液管装500µM的药物。电流脉冲测量膜电阻的变化。插图来自Lasater和Dowling, 1982(125)。
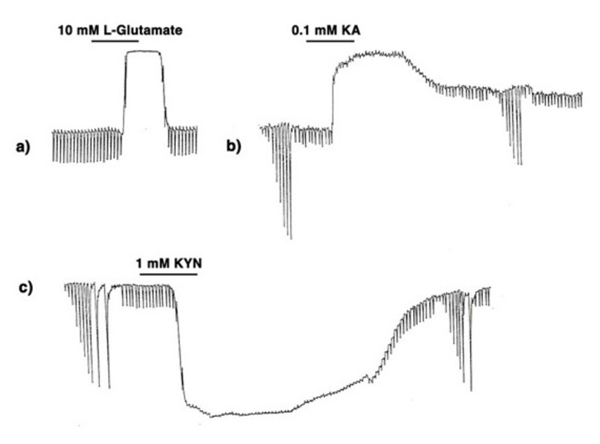
通过确定兴奋性氨基酸转运体(EAATs)对谷氨酸和天冬氨酸的高效吸收系统,第一个问题得到了回答(121,122)。aeats有效地从细胞外空间去除兴奋性氨基酸,从而大大减少外源应用的天冬氨酸或谷氨酸到达锥体到水平细胞突触的浓度。视网膜谷氨酸转运蛋白在Webvision的其他地方有综述。当不可运输的兴奋性氨基酸类似物被应用时,需要相当低的浓度来对水平细胞产生作用(109,123)。如图12所示,将10 mM l -谷氨酸的效果(A)与0.1 mM海氨酸(B)进行比较。海氨酸是脊椎动物水平细胞中ampa -海氨酸型谷氨酸受体的激动剂,但不是aats的底物,在浓度低100倍时产生的效果与l -谷氨酸相似。在这两种情况下,水平细胞去偏振和光响应丢失。为了进一步支持兴奋性氨基酸受体假说,兴奋性氨基酸受体的非选择性拮抗剂kynurenic acid(124)使水平细胞超极化,也失去光响应(图12 C)。
图12。l -谷氨酸的作用(一个)、海锑酸(b)及kynurenacid (c)对甲鱼视网膜l型水平细胞的膜电位和光响应的影响。插图来自帕尔曼。
兴奋性氨基酸的确切身份争论了十多年。为了在l -谷氨酸和l -天冬氨酸之间做出选择作为光感受器神经递质的选择,在完整的视网膜上设计了多种实验,但结论相互矛盾。直到分离细胞制剂的发展,这个问题才有了明确的答案。Lasater和Dowling(125)在他们的开创性工作中,从鲤鱼视网膜中分离出水平细胞,并用锋利的微电极记录膜电位。由于培养中的这些水平细胞与视网膜回路的所有其他影响(包括光感受器刺激)分离,它们具有高极化静息电位(接近钾平衡电位)的特征。应用低剂量的l -谷氨酸,而不是l -天冬氨酸或d -谷氨酸,诱导去极化,表明l -谷氨酸的选择性受体存在于水平细胞膜上(图11B)。在这种实验方法中,低浓度的l -谷氨酸足以诱导效果,因为在这种制备中,通过摄取系统去除细胞外的l -谷氨酸是可以忽略不计的。
为了揭示谷氨酸门控通道的特性,电压和电流钳技术已应用于来自不同种类的隔离水平细胞。这些通道在0 mV左右具有反转电位,这取决于移液管内和细胞外溶液的组成(123,126 -128)。利用特异性激动剂和拮抗剂对水平细胞中谷氨酸门管的性质进行药理学分析,发现其为AMPA/KA型。它们可被α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)或海蓝酸(KA)特异性激活,并被6-氰基-7-硝基喹啉(CNQX)或顺- 2,3 -哌啶-二羧酸(PDA)拮抗(129,130)。当激动剂海因酸激活AMPA/KA离子通道时,诱导电流比l -谷氨酸诱导的电流大得多,即使浓度更高(127,131)。这种效应被归因于l -谷氨酸对AMPA/KA型通道的快速脱敏作用,而海肽酸却不能(132,133)。谷氨酸诱导脱敏的选择性阻滞剂(如环噻嗪)导致谷氨酸诱导电流达到与酪氨酸诱导电流相似的水平,这支持了水平细胞主要表达ampa型谷氨酸受体的结论(134-136)。鲶鱼水平细胞除了表达AMPA/KA受体外,还表达NMDA受体,这似乎是上述一般结论的一个例外(131)。此外,有生理学证据表明,在人类视网膜培养的水平细胞中,除了AMPA受体外,还有红氨酸受体(137)。
Metabotropic谷氨酸的影响
谷氨酸也通过代谢途径影响水平细胞。与向电离的ampa -谷氨酸反应不同,代谢作用不会通过水平细胞网络内的膜电压变化进行全球传播,而是停留在局部,只影响附近的细胞质化学。DL-AP4是一种谷氨酸类似物,对III型代谢性谷氨酸受体有选择性,抑制附近电压敏感的钾通道(138)。同样,I组和III组代谢性谷氨酸受体增加了水平细胞中附近电压门控钙电流的振幅(139)。谷氨酸通过调节细胞质pH值(140)进一步调节钙和钾通道的代谢。已经观察到鲶鱼水平细胞上的NMDA受体通过钙调素依赖机制下调电压依赖性的钠和钙通道活性,这也是一种代谢效应(141)。此外,钠通过被刺激的ampa -谷氨酸通道进入刺激了钠的局部活性+K+腺苷三磷酸酶。这反过来在设定膜电位时显得很重要(142)。因此,除了引起光反应本身,光感受器谷氨酸调节各种细胞和膜功能。
电压和时间相关的电导
来自冷血动物和温血哺乳动物视网膜的水平细胞的光反应是由位于质膜内的电压和时间依赖的离子通道形成的(143-146)。五种离子电流;在金鱼(147)、鲶鱼(148)、白鲈鱼(143)、鳐鱼(149)、乌龟(150)、兔子(145)和猫(146)的孤立水平细胞中已发现钠电流、钙电流和三种钾电流。
电压阶跃引起从猫视网膜分离的两种水平细胞(图13A)和从白栖鱼视网膜分离的四种水平细胞(图13B)的膜电流响应。在cat水平细胞中,在电流响应的前10 ms内,向内的钠电流非常明显,而在稳态时,可以看到持续向外的钾电流(图13A)。从电流波形和对电刺激的瞬时和持续响应的I-V曲线可以明显看出,鱼的水平细胞显示出更复杂的电流阵列(图13B)。基本上这四种鱼的水平细胞都表现出相似的离子电流,但它们的相对大小不同。钠电流是向内的,在水平细胞从负保持电位(约-70mV)去极化到约0mV时记录的电流脉冲的最初10ms中可以看到。这与尖峰神经元典型的再生钠电流非常相似。这种电流在水平细胞中的生理作用尚不清楚,因为这些细胞不表现出动作电位。通过对电压和时间的依赖以及对特定阻滞剂的敏感性,已经确定了三种类型的钾通道。当细胞超极化低于钾平衡电位时,向内整流通道引导向内电流。在某些物种中,细胞外钠离子影响这些通道的反转电位,使电流在生理电位下发挥作用(151)。 The sustained outward potassium current (delayed rectifier) is activated at potentials more depolarized than the resting, dark potential of the horizontal cells. The outward transient potassium current (I一个),在负电位快速去极化时激活。在完整的海龟视网膜中,明亮的光刺激终止后,向外的瞬时钾电流被激活,加速l型水平细胞从光偏移处的去极化超调恢复到暗水平。这种效应允许l型水平细胞跟随快速闪烁的刺激,从而改善细胞的频率响应曲线(152)。
l型钙反应是孤立水平细胞的显著特征。这些通道只缓慢地失活,导致长时间的峰值和持续的去极化状态(142,146,148,153)。向外的钾电流本身似乎太弱,无法使这些细胞中的钙电流失活(154),然而谷氨酸激活的电致Na/K atp酶似乎足以恢复超极化膜电位(142)。钙电流有时可能导致水平细胞的光响应振荡(155)。
GABA受体和转运蛋白
有些(但不是所有)水平细胞类型会积累GABA(51)。水平细胞GABA的一个可能目标是其他水平细胞。Kamermans认为GABA是这些神经元之间正反馈的中介(156)。在许多物种中一个和/或伽马氨基丁酸C受体位于水平细胞上。钱和道林发现了视网膜GABAC受体。它们定位于离体的白鲈杆水平细胞的膜上(157)。视网膜GABAC受体在Webvision的其他地方进行了回顾。从GABA电流一个在游离的兔水平细胞中发现受体(158)。两个伽马氨基丁酸一个和GABAC受体电流和GABA转运体电流都发生在孤立的鲶鱼水平细胞中(159,160)。从鳐鱼(161)或斑马鱼(162)中分离出的水平细胞显示没有GABA受体生理学的证据,但具有GABA转运体生理学。水平细胞的GABA回路是物种特有的,尽管如此,GABA似乎是脊椎动物外丛状层中的一个重要信号分子,GABA的作用包括水平细胞之间的信号传递。
7.间隙连接与空间特征
缝隙连接
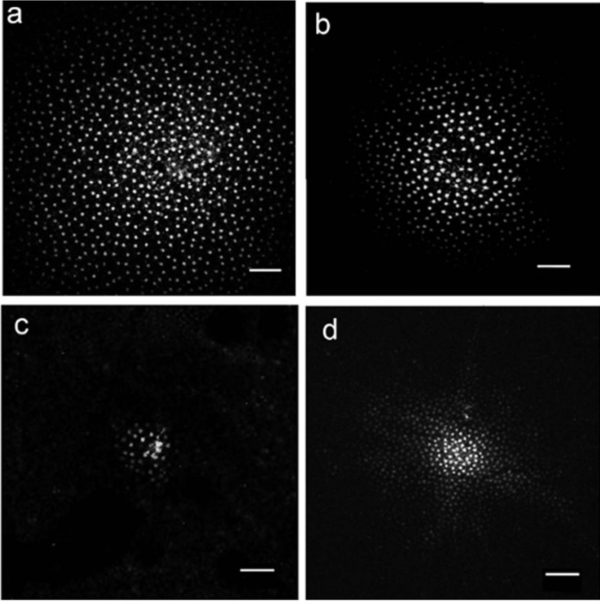
在包括哺乳动物在内的所有脊椎动物视网膜中,水平细胞的特征是彼此树突之间的大表面积间隙连接(图3c)(163,164)。这些连接允许水平细胞网络中的小分子和离子横向流动。间隙连接示踪剂如路西法黄或神经生物素被注射到该层的一个水平细胞中,并扩散到数百个相邻的细胞,形成相互连接的水平细胞网络的显著图像(图14,15A)(14, 66, 67, 84, 165, 166)。缝隙连接只在相邻的相同生理类型的水平细胞之间形成,如图14和15A所示。通过将神经生物素注入其中一个细胞,可以发现龟H2细胞(图15A,左图)和兔a型细胞(图15A,右图)的网络。兔a型水平细胞之间的间隙结连接可以容纳500道尔顿(74)大的分子。水平细胞之间间隙连接的通透性,因此染料偶联,受到细胞内和细胞外环境以及其他视网膜细胞释放的诸如多巴胺、视黄酸、一氧化氮或氢离子等化学物质的影响(见神经调节剂一节)。
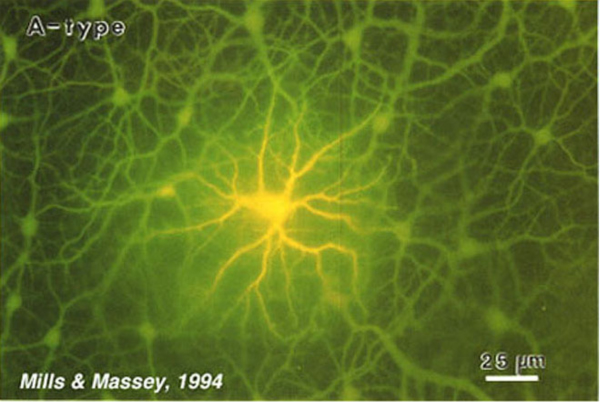
图14。染色法显示兔水平细胞网络。将路西法染料注射到一个细胞中,通过连接a型水平细胞的缝隙连接扩散,显示中心注射的细胞和数百个邻近细胞。插图来自Mills和Massey, 1994(67)。
接受域属性
水平电池之间的缝隙连接对小离子具有高渗透性,因此,作为电子信号在水平电池层内横向传播的低阻途径。因此,水平细胞通过化学突触直接从光感受器接收兴奋性输入,也通过与相邻水平细胞的缝隙连接间接接收兴奋性输入。水平细胞间缝隙连接的生理结果是产生一个非常大的感受野,并向远处的视网膜区域扩散,这些区域超出了树突与光感受器直接接触的范围(10,66)。
水平细胞的感受野是用几种空间协议测量的。最常见的是(1)检查对一系列直径不断增加但辐照度固定的同心点的反应,或(2)检查对视网膜上不同位置的狭长光缝的反应。在这两种情况下,响应振幅至少可以用描述电阻平面内电流流动的微分方程(16,167,168)来建模,或者等效地用相互连接电阻的离散无源网络(53)来建模。图15B显示了用一系列固定强度的同心点刺激隐杆线虫(pseudodemys scripta elegans)视网膜中的l型水平细胞的实验。第一个向左的光反应是由一个超饱和强度的刺激引起的,这个刺激照亮了细胞的整个感受野。这是最大的光响应。随后,在不同刺激直径的次饱和光刺激下,引发了一系列6种光反应,如图所示。随着视网膜被照亮区域的缩小,光响应振幅逐渐减小(图15B;图)。振幅的减少不是由于感光细胞的突触输入减少,因为即使是小的斑点刺激也比细胞的树突范围大。 Thus, it is suggested that the low amplitude of the responses to small spot light stimuli are due to shunting of the local photoreceptor input into neighboring horizontal cells through gap junctions. With full-field illumination, all the horizontal cells are evenly illuminated, equipotential, and therefore, no current flows between them. With small spot illumination, the membrane potential of non-illuminated horizontal cells is different from that of illuminated cells causing electrical currents to flow between them and thus, to shunt the responses of the illuminated cells.
猫a型水平细胞的感受野,用狭缝的光映射,如图16所示。当狭缝以细胞为中心时,最大响应的两侧会出现响应振幅的指数衰减。注意,这种最大狭缝反应总是小于由覆盖被研究细胞的整个感受野的相同强度的大光刺激引起的反应(V马克斯).红色感受野(图16A)表示猫红色锥信号的空间范围,蓝色感受野(图16B)表示杆状信号的空间范围,两种信号成分均出现在同一水平单元内。这些信号有一个共同的中心,但空间常数不同。
水平细胞感受野的尺寸可以量化。使用可变直径的光斑,一个常见的程序是找到引起最大响应的最小光斑直径。另一种测量方法是感受场长度常数λ。对于基于水平单元层电流流动的模型,λ被定义为将响应振幅降低1/e所需的狭缝位移。(16,167, 169, 170)。基于数据经验曲线拟合的lambda的其他一些定义也被提出(10,171)。在基于水平细胞合胞体电流流动的模型中,感受野的大小与lambda直接相关,lambda与水平细胞的膜电阻直接相关,与水平细胞之间的耦合电阻成反比。cat a型水平槽(图16A)中锥信号分量的空间常数为250 μm。同一单元中杆信号分量的空间常数为200 μm(图16B)。这说明即使在同一个单元中,根据被测量的内容; somewhat different receptive fields can be inferred. The concept of field size is not monolithic.
水平细胞感受场的特殊宽度有几个用途。首先,水平细胞作用于光感受器和双极细胞,这两种细胞在感受野中心比水平细胞窄得多,可以在这些窄场神经元的区域功能的远端分支中看到。其次,水平细胞类型可以通过感受野的大小和性质来区分。在龟视网膜中,两种类型的光度水平细胞被早期识别;L1和L2(53)或分别为大感受野(LRF)和小感受野(SRF)水平细胞(81)。L1 (LRF)细胞的感受野直径大(>3 mm),而L2 (SRF)细胞的感受野直径约为2 mm。这两种l型水平单元在光谱特性(172)和对周围照明的响应性(173)方面也有所不同。LRF和SRF细胞的解剖染色实际上揭示了它们是同一细胞的两个电隔离部分。LRF为H1的轴突末梢,SRF为细胞体(图2a)(53)。因此,感受野的测量进一步证明了一个水平细胞可能有两个独立的区域总和区域。
水平细胞合胞体不能用静态被动电模型完全描述。水平细胞层内的电阻随着光照和时间的变化而变化,因此,感受电场的大小(λ的大小,或长度常数)也会变化(169,174,175)。一般来说,接受场长度常数的大小与用来测量它的光刺激的强度有关(16,167,172,176,177)。当环境照度增加时,长度常数先增加到峰值,然后下降(16,169,175)。龟视网膜c型水平细胞的空间特性取决于光刺激的颜色(91,178)。当光刺激的空间模式发生改变时,c型水平电池的光响应波形可能发生剧烈变化,特别是当光的波长接近响应极性反转的区域时(91)。这是因为去极化和超极化机制可能在大小上有所不同。在孤立的水平细胞对中,偶联电流随着时间的推移有所下降(179),这可能会在感受野中引入另一种时间依赖性。进一步的感受野大小依赖是由多巴胺等神经调节剂引入的(见下文)。
8.反馈。
对锥体感受野的影响
水平细胞是光感受器的突触后细胞,但也是突触前细胞反馈循环。水平细胞通过这些反馈通路将宽视场的视觉信号发送回视锥细胞的窄中心机制(180-186)。这些途径的影响是通过调整用于引起视锥细胞反应的光刺激的大小、形状和颜色来揭示的。面积和亮度对虎蝾螈视网膜锥光响应的影响如图17(183)所示。每对反应都是由相同强度但不同大小的光刺激引起的。无论刺激的大小,每对光响应(初始超偏振)的早期on相位都是相同的,但之后的相位很大程度上受刺激大小的影响。对于小点刺激,在初始超极化后,细胞轻微恢复到暗电位,但膜电位在整个刺激持续时间内保持在超极化水平。当使用大的斑点刺激时,在初始超极化阶段之后可以看到一个显著的去极化(图17中的箭头)。这一结果似乎与刺激强度无关。后期去极化电位反映了从水平细胞到视锥细胞的负反馈通路的激活。 Feedback effects are particularly large when cone intracellular chloride concentrations are artificially elevated (183, 185).
图17。虎蝾螈视网膜l型水平细胞反馈通路对锥体反应的贡献。锥光反应是由不同强度的光刺激引起的,覆盖一个小的或大的点。插图来自Lasansky, 1981(183)。
在海龟视网膜中,通过观察大小和颜色对视锥反应的影响,可以揭示水平细胞到视锥的反馈通路(图18)。对于小的斑点,红色和绿色的光刺激可以调整亮度,直到红色和绿色锥体诱导出等幅超偏振。在这些小点刺激下,红色锥的光响应在形状上非常相似,不管波长如何(上面的对响应)。然而,当相同的两种波长的光刺激的直径增加时,从绿色锥体到l1型水平细胞的兴奋性输入激活了反馈通路,导致红色锥体对绿色光刺激的反应变为短暂的双相的(图18,左下对)。在绿色锥体中,从红色锥体输入到l1型水平细胞的反馈通路的贡献更加明显,在大直径红光刺激下,绿色锥体中引发去偏光响应(图18,右下对)。蓝色视锥细胞也从l型水平细胞(187)接收反馈信号,如图18所示(右手痕迹)。一个大直径的红光刺激被用来选择性地隔离可能的输入由这些反馈通路介导。在暗适应状态下,在初始超偏光阶段之后可以看到一个小的去偏光后电位(踪1)。在红色背景光下,选择性地使红色视锥细胞(l -视锥细胞)脱敏,红色光刺激会引起一个纯超偏光响应(踪2)。而蓝色背景增加了反馈通路的相对贡献,因此获得了去偏光响应(踪3)。这些和其他解剖学和生理学研究为提出视锥细胞和水平细胞之间的反馈模型可能是颜色对抗的基础提供了基础(37,42,86,188)。
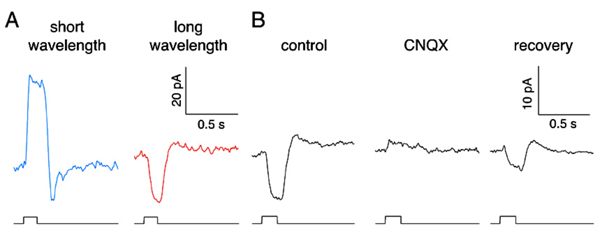
哺乳动物缺乏反色水平细胞,而灵长类动物的短波视锥细胞(蓝色视锥细胞)中可以看到反色反应(185)。在短波长的刺激下,灵长类动物的蓝色视锥细胞通过光转导产生外向电流,以响应外段阳离子通道的关闭。但是长波长的刺激会引起向内的电流(图19A)。灵长类动物的蓝锥和海龟的蓝锥相似,都表现出来自长波长选择的l型水平细胞的负反馈。长波长的向内电流,即反馈响应,被CNQX(水平细胞AMPA/kainate膜通道的拮抗剂)消除(图19B),支持水平细胞是锥光感受器负反馈输入来源的概念。此外,蓝锥反馈电流的特性与钙电流相似(185),支持了长期以来的观点,即水平细胞对锥的反馈是通过钙通道的调节进行的(183,189)。
因此,灵长类动物的视网膜中有蓝视锥细胞,但没有蓝视锥细胞。与其他脊椎动物的区别似乎在于水平的细胞回路。虽然灵长类动物视网膜的H2细胞具有一定的蓝锥选择性(图10),但它显然没有足够的选择性来显示蓝锥去极化反馈信号对红色刺激。直接超极化的长波长锥输入到H2细胞可以掩盖蓝锥反馈响应。
突触的反馈
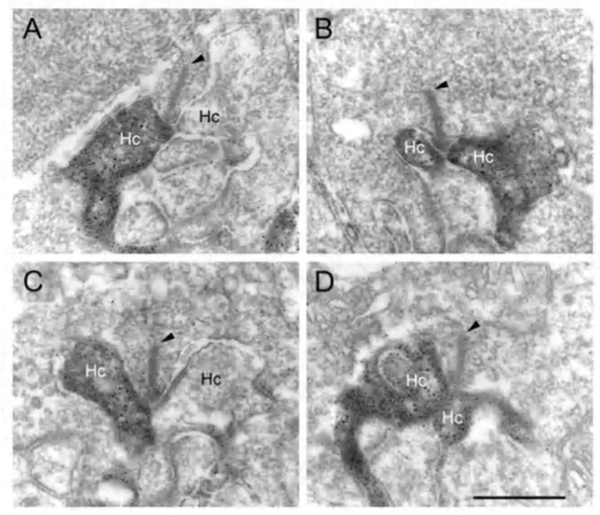
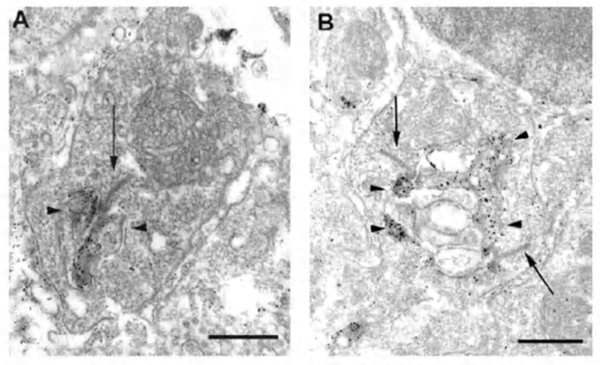
从水平细胞到视锥细胞的负反馈电路被认为发生在水平细胞外侧元件上,这些横向元件在三联带突触的光感受器末端内陷(图3a)。问题是,除了人类视网膜(190)外,从未在侧位单元中看到突触前囊泡簇的图像,而且只在棒球内轴突末梢内陷时被注意到。然而,参与突触囊泡与质膜融合的SNARE蛋白syntaxin-4已经定位于小鼠水平细胞的锥体和杆状细胞的横向单元(图20)(191),泡状GABA转运蛋白VGAT也一样(图21)(192)。这些分子都表明水平细胞中的突触前活性。此外,鱼的视网膜在锥体蒂的水平细胞侧部元件的树突末端有独特的小刺(图3b)。棘小体可能是水平细胞到视锥细胞的反馈点,因为在负反馈效应最明显的背景光照下,棘小体的形状会改变并扩大(57,58,193 -196)。
反馈神经递质有几种候选者。在鲤类视网膜中,H1水平细胞运输GABA,并在细胞质中积累(47,51,162,197,198)。gaba诱导的电流可以记录在从海龟视网膜分离出的红敏和绿敏锥体的末端(199,200)。在暴露于GABA或其拮抗剂(201,202)时,鱼c型水平细胞中的颜色对抗会被消除。然而,对其他物种的研究未能显示GABA的作用支持GABA作为水平细胞的抑制性反馈神经递质的作用。GABA没有消除海龟(203)或非洲爪蟾(89)的c型反应,也没有影响猴子(204)的锥体环绕反应。在海龟、鲶鱼、鳐鱼和金鱼视网膜的l型水平细胞中,GABA和相关药物诱导的去极化与水平细胞膜中电致GABA转运蛋白的激活一致(149,159,160,203,205)。尽管这些细胞明显具有氨基丁酸吸收系统并积累氨基丁酸,但氨基丁酸介导水平细胞对锥光感受器的负反馈的想法还没有得到普遍的实验验证。水平细胞GABA仍然可以直接对双极细胞树突或其他水平细胞过程具有前馈作用(156,205)。另外,水平细胞上的GABA受体可能只是为了在细胞外GABA存在时限制转运体产生的膜去极化。
进一步的反馈模型提出,突触间隙中质子浓度升高通过抑制光感受器钙通道介导反馈(206)。质子缓冲器,特别是氨基磺酸盐,如HEPES,阻断反馈(207-212)。虽然人们普遍认为某些pH缓冲液会阻碍反馈,但目前对突触间隙中pH的改变是否是其机制存在分歧(213,214)。
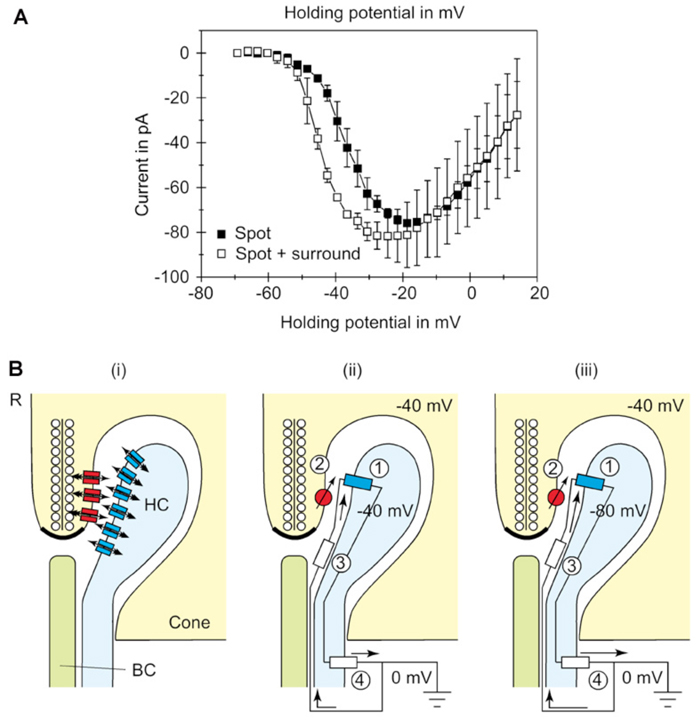
大多数反馈模型认为光感受器末端突触前钙通道的调节是关键。Verweij等人(1996)(215)在有光点或环形光照射的情况下,利用锥细胞的电压钳记录,认为反馈调节了锥椎弓根中钙通道的电压依赖性(图22A)。该解释从一个旧的电模型(5)出发,提出水平细胞可以启动大量的细胞外电流通过半间隙结通道进入锥体三联突触内受限的细胞外空间(图22B)(68,70,72,189, 216)。在光刺激下,l型水平细胞超极化,增加了从细胞外空间通过半间隙结通道流入水平细胞侧元的阳离子流入的幅度。这会导致细胞外空间的超极化。这种由连接蛋白Cx55.5组成的半间隙连接已在斑马鱼视网膜的水平细胞侧位元件中被解剖证实(图3d)。细胞外超极化激活电压依赖的钙通道,它们以细胞内去极化相同的方式感知变化,导致钙进入,并增加谷氨酸释放。这个想法得到了一些支持,因为当半通道被卡苯酮(一种特定的间隙结阻滞剂)阻塞时,锥内的反馈信号就被消除了(189,204)。
斑马鱼的基因敲除进一步证明了连接蛋白55.5和半缝隙连接对反馈的重要性。对视锥细胞的反馈、行为对比敏感度和水平细胞的颜色对抗在这次敲除中都减弱了。由于这种连接蛋白只在水平细胞中表达,水平细胞电路的扰动可能是原因之一。奇怪的是,当水平细胞处于超极化状态时,敲除效应最强,但当水平细胞处于去极化状态时,敲除效应不那么明显(73)。
9.调制的生理机能。
在光照条件的变化中,视网膜细胞释放的各种体液因子改变了水平细胞的特性。这些化学物质,通常被称为神经调质,被认为可以调节视网膜中的信息处理模式,以使视网膜功能与周围环境相匹配。神经调节剂通过直接的突触相互作用或通过体积传递到达水平细胞。在后一种模式中,细胞间的通信是由化学物质从源细胞释放到细胞外空间后的被动扩散介导的。多巴胺是研究最为广泛的视网膜神经调制剂,但近年来一氧化氮和视黄酸又被添加到名单中。本节讨论了这些神经调节剂对脊椎动物水平细胞的作用。
多巴胺
含有多巴胺的神经元位于视网膜的无分泌细胞层。在最初被发现的鱼类中,多巴胺能细胞是丛状细胞(IPCs),在无分泌细胞层中有细胞体,并向外丛状细胞层发送长过程,在那里它们在水平细胞上树结和突触。在其他物种(如海龟和大多数哺乳动物)中,多巴胺能细胞是无分泌细胞,很少有突起延伸到外丛状层(217),因此多巴胺必须通过内核层通过体积扩散到达水平细胞。多巴胺对脊椎动物水平细胞的作用已经被广泛研究和回顾(218),它至少涉及4种不同的作用。
(1)通过染料偶联实验、电生理学对感受野大小的测定(119、166、176、219-222)和从分离细胞对的贴片记录(69),多巴胺降低了间隙-结耦合的程度。多巴胺缩小了感受野,并降低了来自完好鱼视网膜的水平细胞的光响应振幅(图23A)。在与多巴胺溶液的融合过程中,在小点刺激下记录的光反应振幅比在对照条件下记录的相同刺激下的光反应振幅更大(图23A)。对斑点刺激的反应增加表明邻近的非发光水平细胞的分流减少,这与多巴胺解耦水平细胞网络的概念一致(220)。通过多巴胺d1型受体激活腺苷酸环化酶降低间隙结电导(223)。
多巴胺通过减少间隙连接偶联,限制了神经生物素(一种低分子量(323道尔顿)示踪分子)在水平细胞层内注入细胞后的扩散。在猴子视网膜的H1细胞中,神经生物素示踪场在黑暗适应期间最大(图24A)。多巴胺D1激动剂SKF38393减少示踪场的大小(图24D),光适应(图24B)和间隙结阻断剂甲氯胺肟酸(图24C)也是如此。猴H1细胞的暗适应空间常数非常大,超过1000 μm(222)。在小鼠视网膜中也发现了类似的结果,D1受体拮抗剂(SCH23390)对多巴胺D1受体的阻断扩大了示踪剂的扩散范围,cAMP类似物8-溴环GMP减少了示踪剂的扩散。所有的观察结果都与D1受体、camp介导的机制一致(224)。
多巴胺对感受野的调节因物种而异。兔a型细胞体之间的神经生物素分布对pH高度敏感(165),实际上只有在pH 7.2 +/- 0.05时才能观察到。尽管如此,在兔b型水平细胞的轴突末端系统中,感受野大小发生了特别显著的调节(233)。多巴胺对示踪剂偶联的调节在小鼠视网膜(224)和猴子视网膜(图24)(222)中表现强劲。示踪剂偶联在鳐视网膜的杆驱动水平细胞之间是多巴胺不敏感的(234)。
在孤立的水平细胞对中,多巴胺解偶联间隙连接(69)。在这一准备中,隙结耦合及其由多巴胺调节的生物物理学可以被详细检查。在斑马鱼中,间隙结通道的单一电导为50-60 pS,打开时间为~10 msec。多巴胺减少了这些通道的打开时间和打开频率,净减少2-3倍(235)。该作用通过D1激动剂介导,并被cAMP类似物8-溴-cAMP模仿,这表明细胞内机制涉及cAMP的增加,这是D1受体的一种常见作用(179)。对分离的鲶鱼水平细胞对的平行研究也得出了类似的结果。多巴胺D1受体提高细胞内cAMP,闭合间隙连接。此外,细胞内pH和Ca2 +离子被排除为介质(236)。
(2)多巴胺诱导鱼水平细胞中棘小体的形成,其方式类似于在强光背景照明下所见(193,225)。
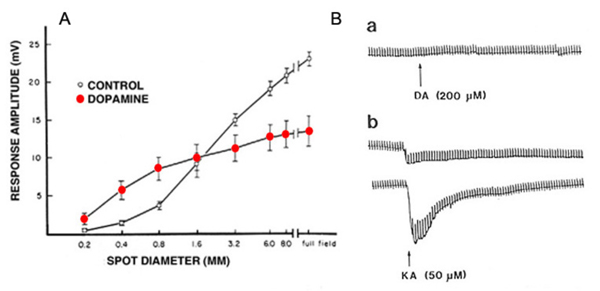
(3)在鱼视网膜中,多巴胺降低了水平细胞光响应的振幅(220,226),如图23A所示。这一现象是由于多巴胺调节了l -谷氨酸与水平细胞膜上AMPA/KA受体之间的相互作用。多巴胺增加了l-谷氨酸与水平细胞膜受体的结合(227),如图23B所示。多巴胺本身在孤立的水平细胞中没有引起电流(图23B,上示踪),但它显著增强了钾酸盐诱导的谷氨酸受体电流(图23B,下示踪)。进一步的研究表明,这种多巴胺作用依赖于细胞外镁离子(228)。在完整的视网膜中,水平细胞的光反应反映了谷氨酸与其受体的解结合。如果多巴胺增加了谷氨酸对水平细胞膜上受体的亲和力,那么光启动时解结合的速度就会变慢。猫和兔水平细胞的闪烁光反应实际上是被D1和D2选择性多巴胺激动剂相位延迟的,这与谷氨酸解结合较慢的想法一致。在这些物种中,闪烁光响应的振幅在昏暗的光线下增加,而在明亮的光线下减少(229)。Pflug等人(229)认为多巴胺诱导的水平细胞与谷氨酸结合的增加可能会诱导一种持续的去极化偏差,通过反馈相互作用将锥状钙激活转移到更去极化的水平,倾向于促进暗刺激突触的传递,而截断亮刺激突触的传递(229),这是对Mangel和Dowling(230)提出的观点的详细阐述。
在其他物种中,情况似乎并非如此。这种调节在海龟视网膜中不明显(176,221)。
(4)多巴胺改变爪蟾视网膜水平细胞杆状和锥状输入的平衡,以增加在暗适应状态下的杆状贡献和在光适应状态下的锥状贡献。这种作用被认为取决于突触后AMPA/KA受体对杆状细胞和锥状细胞的不同多巴胺敏感性(231,232)。
一氧化氮
视网膜生理调节中一氧化氮(NO)的参与是由含有从l -精氨酸合成NO的一氧化氮合成酶(NOS)的细胞的存在所表明的(237)。在研究的每一种脊椎动物视网膜中都发现了NOS异构体的免疫反应性或NADPH-diaphorase活性的表现(238)。在所有物种中,NOS发生在某些类型的无分泌细胞中,但在光感受器、水平细胞、双极细胞和Müller细胞中也有报道。在鱼视网膜中,免疫染色和NADPH返照酶组织化学证实了水平细胞中NOS的存在(239-241)。在海龟视网膜中,在光感受器带状突触的水平细胞突起和光感受器的内节段中发现了n-NOS,在H1细胞轴突末端和Müller细胞中发现了e-NOS(47,242 -244)。在兔视网膜中,NADPH返光酶活性是水平细胞中NOS存在的一个指标,已被证明依赖于适应状态和谷氨酸途径的活性。它在黑暗适应状态下(245)或通过激活AMPA/KA型受体(246)而增加。事实上,一氧化氮被认为是水平细胞反馈机制的一个参与者(247)。
不管NO的确切细胞来源是什么,这个分子对水平细胞的生理有深远的影响。通过外源应用(NO供体)或通过添加l -精氨酸(合成其底物)来提高NO水平,会减小水平细胞感受野的大小(177,248,249)。这种效应反映了NO对相邻水平细胞间缝隙连接的直接作用。它被认为是通过cgmp依赖的蛋白激酶途径介导的(249,250),其途径与cAMP平行,即多巴胺能调节。
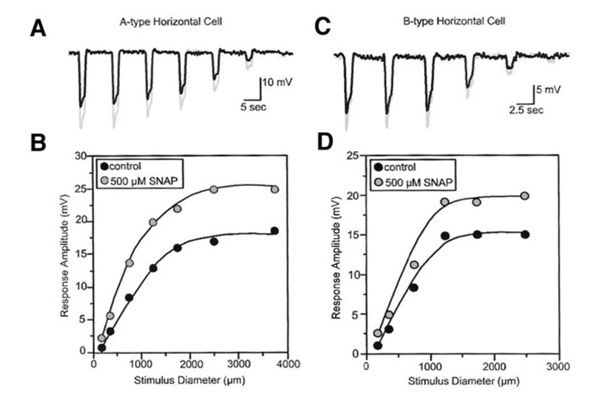
NO修饰兔视网膜中a型和b型水平细胞的光响应(图25)。这些反应是由一系列固定强度和不同半径的圆盘引起的,无论是在对照条件下还是在暴露于SNAP (NO供体)时。对于每一种光刺激,与对照条件相比,SNAP应用期间的光响应更大(灰色与黑色响应,图25)。如图25B和25D所示,分别在A和C部分显示的光响应峰值响应是作为刺激直径的函数绘制的。SNAP明显引起对大直径刺激的光响应增强。NO在兔视网膜远端起作用,增强水平细胞的光反应,减少感受野的大小(249)。
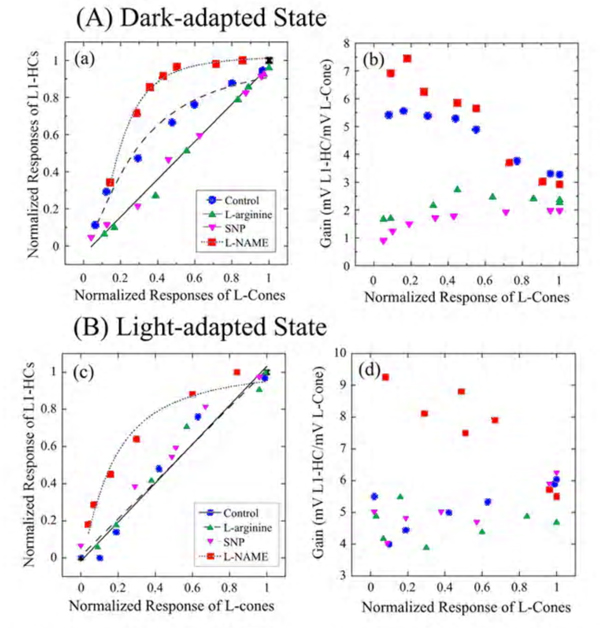
NO在鲤鱼(177)和乌龟(251)的l型水平细胞中也有类似的水平细胞反应增强。水平细胞中的NO效应可以反映NO作用于光感受器外节段的光转导过程(251,252)或光感受器释放的神经递质(253)。此外,NO可以调节l -谷氨酸与其水平细胞膜受体之间的相互作用(254),因此可以独立于对光转导的影响而改变水平细胞的响应性。为了区分上述可能性,我们在龟眼杯制剂中研究了no相关药物对锥光感受器与l1型水平细胞(L1-HC)之间传递功能的影响,如图26(251)所示。在暗适应状态下(图26A),锥体到L1-HC突触是非线性的,其特征是对微弱光刺激的高度放大,引发低振幅锥体光响应。添加L-NAME降低视网膜NO水平,增加了这种非线性;添加l -精氨酸或SNP提高视网膜NO水平,减少了这种非线性,使细胞的锥向水平传递函数线性化。在光适应状态下(图26B),在与高NO水平一致的控制条件下,锥- L1-HC传递函数呈线性关系。进一步增加视网膜NO(添加L-arginine或SNP)不改变传递函数和突触放大,而降低视网膜NO(添加L-NAME)则使传递函数为小振幅锥体光响应的高放大非线性传递函数。从图26中可以清楚地看到从锥细胞到水平细胞的突触转移的直接影响。这可能包括神经递质释放和/或神经递质与突触后受体的相互作用。
与多巴胺相反,NO不影响鱼水平细胞在背景光照射下棘突形成的过程(177)。
视黄酸
类维生素a在眼睛中具有非常重要的作用,在光色素循环和眼睛的胚胎发育中都有作用。类视黄质11-顺式视黄醛是视紫红质分子的发色团,是脊椎动物光感受器的视觉色素(255,256)。类视黄酸激活了在眼睛发育过程中很重要的转录因子(257-260)。最近有人提出维甲酸的进一步作用;与背景适应相关的神经调质,尤其影响水平细胞(64,65,261)。视黄酸是在明亮光照下视紫红质转导过程的副作用,在色素上皮中产生。
维甲酸诱导水平细胞末端树突的突触可塑性,促进鱼水平细胞中刺小体的生长,其模式与背景光诱导的模式相似(64,65)。它对哺乳动物和非哺乳动物视网膜水平细胞之间的电耦合有显著影响,并减少水平细胞的感受野(261,262),如图27所示。在鲤鱼、兔和小鼠的视网膜制剂中添加视黄酸,可降低相邻水平细胞间缝隙连接的电导,从而降低染料偶联度(图27a),其方式与背景照明时看到的类似。水平细胞的细胞内记录也显示,视黄酸产生的效果类似于光适应。视黄酸增加了水平细胞对全场刺激的光响应振幅(图27b)。视黄酸降低了对明亮光环的刺激反应,而增加了对光点照明的反应(图27c)。因此,视黄酸就像多巴胺和一氧化氮一样,似乎可以调节脊椎动物水平细胞的生理特性,以便在环境光照条件变化时调节它们的功能。
10.功能角色。
脊椎动物视网膜中水平细胞的主要功能是:1)启动视网膜中二级和三级神经元的空间竞争接受野的组织;2)调节不同光照条件下的光感受器信号;3)调节突触增益。这些作用代表了视网膜第一突触水平上的神经元信号处理和神经元适应。
自Svaetichin(80,263)首次描述脊椎动物视网膜中的s电位以来的半个世纪里,我们在理解水平细胞影响光感受器反应的动力学和空间组织的多种方式方面取得了进展,并因此影响了所有下游视网膜神经元的生理学。这些包括杆锥平衡的改变,远端颜色对抗,中心环绕对抗,以及光感受器突触的增益调节。此外,水平细胞本身受神经调节控制,并在多巴胺、视黄酸和一氧化氮的影响下重组其突触连接、谷氨酸敏感性和感受野。水平细胞在视网膜内外之间形成了重要的连接,因为这种细胞类型控制视网膜远端信号处理,同时自身也受到视网膜内部甚至大脑本身的离心神经调节控制的影响。
光感受器突触调制
钙进入突触结构,通过促进神经递质负载的突触囊泡与突触前膜的融合,诱导神经递质的释放。钙通过特殊的膜通道进入,由电压、第二信使和神经递质调节。在水平细胞调节锥突触增益的表观模型(189,215,216)中,去极化、暗适应水平细胞在细胞外空间产生电梯度,降低钙进入锥末端的速率。这反过来又降低了神经递质的释放速率(图22B)。背景光照使水平细胞超极化,增加细胞外电流,将锥端钙通道的电压依赖性转移到更高的超极化水平(图22A),并与没有水平细胞反馈时的释放速率相比,增加了给定电位的锥的发射器释放速率。水平细胞的光诱发超极化增加了视锥细胞的神经递质释放,而视锥细胞的光诱发超极化抑制了同样的释放。
水平小区的水平小区反馈调制
水平细胞调节从视锥细胞释放的发射器,完成水平细胞和视锥细胞之间的负反馈循环。这反过来又调节水平细胞膜电位。当水平细胞去极化时,流入锥突触的钙减少,从突触流出的递质也减少。这种效应使水平细胞膜电位向超极化方向移动。因此,水平细胞膜电位由网络控制,而不是严格由细胞本身固有的因素控制。
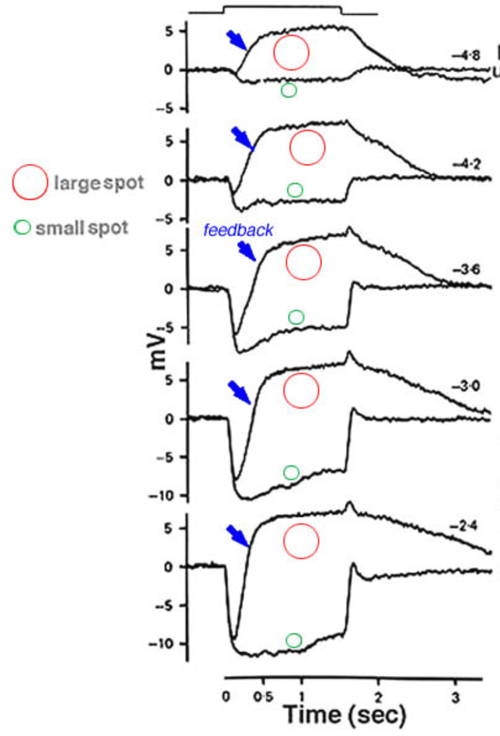
水平细胞的感受野没有明显的中心环绕组织;然而,它们确实表达了颜色的对立,这很可能是它们自己反馈的结果。这在上面的生理类型一节中进行了讨论。水平细胞的感受野也从它们自己的反馈回路中显示出空间效应的证据。当添加反馈刺激的环形背景时,水平细胞的小斑点响应在振幅上增加,并在时间过程中加快(图28)。在插图(264)小光点中,白噪声刺激被用来计算在光点有或没有环空的条件下的脉冲函数。白噪声脉冲函数对响应动力学的变化提供了非常准确的描述。很明显,在反馈刺激环空的存在下,小点响应的增益增加了,响应的时间调谐改变为更高的频率和更短的延迟。增益的增加与这样一种观点相一致,即光感受器突触传递的抑制反馈影响被环去除,从而导致更大的传递器释放,因此光对释放的调节作用更大。动力学的变化尚未建立模型,但似乎光感受器突触间隙的谷氨酸清除也通过反馈而加速。
图示效果(图28)显示了海龟和鲶鱼水平细胞(264),但也报道了非洲爪蟾、泥狗和猫水平细胞(168、265、266)。在后一种植物中,水平细胞的反应包含杆状和锥状混合信号。在这些物种中,特别棒选择性的广域刺激能够有效地增加锥驱动的斑点反应的振幅并缩短其潜伏期(168,265,266)。这种效应被认为类似于“抑制杆锥相互作用”(SRCI),一种行为范式,昏暗的杆背景使闪烁的、锥选择性的小斑点更明显(267)。这些观察结果表明,反馈提供的不仅仅是广域抑制视锥细胞,它还调节突触增益和响应动态。
双极细胞感受野
双极细胞以相反的电压极性响应照亮中心或周围的光刺激(4,268)。双极细胞将水平细胞负反馈和突触增益调制视为空间竞争。这对于ON-和OFF-center双极细胞都是正确的。环形光刺激引起的水平细胞超偏振导致光感受器发射器释放增加,这与视锥细胞被小光点超偏振导致的发射器释放减少正好相反。因此,通过水平细胞反馈到视锥细胞,对于双极细胞,广角环形刺激与小点刺激的效果正好相反。反馈也提供了双极细胞的突触增益。双极细胞的小斑点中心反应,以及水平细胞的小斑点反应,都被反馈放大(265,269)。
水平细胞反馈不一定是影响双极细胞感受野结构的唯一方式。水平细胞可以直接撞击双极细胞,将视觉信息转发给这些二级视网膜神经元。在非哺乳动物视网膜中已经描述了从水平细胞到双极细胞的典型化学突触(27,271)。在一项研究中,在APB阻止光感受器向ON-center双极细胞的突触传递的情况下,光刺激在双极细胞中诱导了超极化反应,从而支持了可能来自水平细胞的直接输入的想法(123)。
前馈神经递质的最佳候选者是氨基丁酸,正如在蝾螈视网膜上的实验所见(272)。水平细胞产生伽马氨基丁酸合成酶GAD,其亚型为GAD 65或GAD 67 (273);此外,在某些物种中,它们表达对GABA的吸收系统(51,161)。伽马氨基丁酸一个在猫、猕猴和人类视网膜的扁平和内陷双极细胞的树突状顶端的水平细胞突触后发现了受体(274,275)。水平细胞对GABA的抑制可能是OFF双极细胞的拮抗包围,而on双极细胞则需要GABA的激发。突触后双极细胞的GABA反应是由氯梯度介导的。这种梯度在一定程度上是由氯离子转运体的作用决定的。转运蛋白KCC2位于OFF-center双极细胞的树突顶端,可能维持适合GABA抑制的氯离子梯度(276)。ON双极细胞树突表达氯离子转运蛋白NKCC,水平细胞也一样,建立了适合gaba能激发的氯离子梯度。在视网膜远端,GABA转运蛋白可能提供进一步的兴奋通路。这些诱导钠进入,至少是水平细胞(161,162)去极化,但也可能是一些双极细胞。
并非所有的双极细胞都表现出空间拮抗作用。猫视网膜上的杆状系统的on -双极细胞和一些偏离中心的锥体双极细胞似乎缺乏包围(277,278)。无论确切的神经元通路是前馈还是反馈,人们普遍认为水平细胞在视网膜远端神经元的空间信息处理中起着重要作用(3,4,171,279 -287)。
水平细胞反馈也可在两极细胞中产生颜色对抗,因此有助于颜色对抗神经节细胞的生理学。图29B总结了鱼视网膜中根据颜色对抗的级联模型(43,86,288)形成单和双对手双极性细胞感受野的方式。单个对手单元的对手包围很容易建模(图29B,上)。该双极细胞仅从红色视锥细胞接收兴奋性输入,因此被定义为红色偏心细胞。单相和双相水平细胞的负反馈在光谱的红色范围内相互对立,在光谱的绿色和蓝色范围内相互加强。如果来自两个水平单元的反馈程度相同,那么双极环绕将是ON模式,光谱灵敏度在光谱的绿色部分最高。如果单相水平单元的反馈比双相水平单元的反馈弱,那么双相水平单元对周围照明的光谱响应将对红光产生超偏光,对绿光产生去偏光(R-G+)(86)。
在双对位双极细胞(图29B,底部)中,双极细胞在其中心对红光刺激产生超极化反应,对绿光和蓝光刺激产生去极化反应。这种中心颜色对抗是由不同类型的视锥细胞的不同类型输入产生的;兴奋性输入来自红色视锥细胞,抑制性输入来自绿色视锥细胞。事实上,在巨型达尼奥的视网膜中,一种具有双层轴突形态的彩色对照锥双极细胞被发现对AMPA/红氨酸激动剂(OFF型受体)和EAAT激动剂(ON型受体)都有反应,表明来自光谱不同的锥的ON和OFF树突状输入(289)。如果单相和双相水平细胞反馈给两种光谱类型的视锥(86),那么通过绿色视锥的反馈将与通过红色视锥的反馈相反,因为不同的突触相互作用。当从每个水平细胞到红色和绿色锥体的反馈路径不同时,就可以通过反馈路径生成颜色对手。然而,当每个水平细胞对两种视锥细胞的反馈强度相等时,环绕响应可能是消色差的。在这种情况下,两极细胞周围的颜色对抗只能通过一个或两个水平细胞直接输入到两极细胞本身而发生。
水平细胞影响神经节细胞放电
在通过细胞内微电极注射电流直接极化水平细胞膜电位的实验中(图30),神经节细胞放电特征为“包围响应”或“大点响应”(284,290)。在兔水平细胞中注入超极化电流会降低on中心神经节细胞的放电速率,但会增加off中心神经节细胞的放电速率(图30)。这两个动作都类似环绕响应。这种电流诱发的反应反映了水平细胞到视锥细胞的负反馈途径和/或水平细胞到双极细胞的直接输入。这两种可能性的证据都有报道。谷氨酸激动剂2-氨基-4膦丁酸盐(APB)是一种选择性的阻滞剂,用于在锥细胞和on -中心双极细胞之间传输,阻断on -中心神经节细胞的光反应,以及通过向水平细胞注入电流引起的“环绕”反应(290)。此外,亚毫摩尔浓度的钴离子选择性地阻断了从水平细胞到锥光感受器的反馈通路。在海龟中,这导致近端视网膜神经节细胞中没有环绕成分(291)。类似地,反馈阻滞剂HEPES是一种阳离子缓冲剂,可选择性地减弱锥体反应中的水平细胞面积效应,阻断猴子阳伞神经节细胞的环绕反应(209)。这一证据表明,水平细胞在神经节细胞水平上的主要影响是通过与光感受器的相互作用,这种相互作用影响神经节细胞的放电模式,进而在视觉和视觉感知中发挥非常重要的作用。
10.参考文献
1.Svaetichin G。锥动作电位。学报杂志。1953;29增刊106:565-600。
2.D一个ly S.J., Normann R.A.视锥细胞的时间信息处理:光适应对时间总和和调制的影响。视觉Res.1985; 25(9): 1197 - 206。[PubMed]
3.K一个neko A.金鱼视网膜水平细胞、双极细胞和无分泌细胞的生理和形态学鉴定。杂志。1970;207(3):623 - 33所示。[PubMed]
4.维尔布林·f·s,道林·j·e泥鳅视网膜的组织,黄斑泥鳅。2细胞内记录。J Neurophysiol。1969;32(3):339 - 55。PubMed]
5.Byzov A.L., Trifonov J.A.鲤鱼视网膜水平细胞对电刺激的反应。视觉杂志1968;8(7):817 - 22所示。[PubMed]
6.Connaughton V.P., Nelson R.斑马鱼水平细胞的光谱反应包括四相反应和一种新的紫外线主导的三相反应。J Neurophysiol。2010;104(5):2407 - 22所示。[PubMed]
7.Fuortes M.G., Simon E.J.相互作用导致海龟视网膜的水平细胞反应。杂志。1974;240(1):177 - 98。[PubMed]
8.伊扎基·A,帕尔曼·I。鳖视网膜光度水平细胞的光适应。细胞耦合的作用。视觉研究》1984;24(10):1119 - 26所示。[PubMed]
9.Naka K.I., Rushton W.A.鱼(鲤科)视网膜中颜色单位的s电位。杂志。1966;185(3):536 - 55。[PubMed]
10.Naka K.I., Rushton W.A.鱼类(鲤科)s电位的产生和扩散。杂志。1967;192(2):437 - 61。[PubMed]
11.诺曼·r.a.,帕尔曼一世。龟视网膜中红色视锥细胞向水平细胞的信号传输。杂志。1979;286:509-24。[PubMed]
12.诺顿A.L.等。s电位的接受野组织。科学。1968;160(831):1021 - 2。[PubMed]
13.酒井H,中佳K。鲶鱼视网膜中的神经元网络。神经科学研究,1985;2:S227-38。[PubMed]
14.Bloomfield S.A., Miller R.F.兔视网膜水平细胞类型的生理形态学研究。中华神经科学杂志,1982;208(3):288-303。PubMed]
15.D一个cheux R.F., Raviola E.兔视网膜的水平细胞。J >。1982;2(10):1486 - 93。[PubMed]
16.尼尔森·R。猫视锥细胞有杆状输入:猫视网膜视锥细胞和水平细胞体反应特性的比较。J Comp Neurol.1977; 172(1): 109 - 35。[PubMed]
17.Nelson R.等人。猫视网膜中具有独立树突系统的水平细胞。科学。1975;189(4197):137 - 9。[PubMed]
18.聂梅耶,郭志刚,郭志刚。离体灌注猫眼s电位的杆状和锥状信号。视觉杂志1973;13(8):1603 - 12所示。[PubMed]
19.斯坦伯格右杆状和锥体对猫视网膜s电位的贡献。视觉研究》1969;9(11):1319 - 29。[PubMed]
20.铃木恒,平托野生型和珍珠突变小鼠离体视网膜水平细胞的响应特性。J > 1986; 6(4): 1122 - 8。[PubMed]
21.D一个cey D.M. et al.灵长类动物视网膜H1水平细胞的L锥和m锥输入生理学。中国光学学报,2000;17(3):589-96。PubMed]
22.D一个cey D.M. et al.灵长类动物视网膜的水平细胞:无光谱对抗性的锥特异性。科学。1996;271(5249):656 - 9。[PubMed]
23.D一个cheux R.F., Raviola E.灵长类动物视网膜HI水平细胞的生理学研究。生物工程学报1990;39(12):369 - 369。[PubMed]
24.DeebS.S. et al.猴子视网膜L:M锥比的个体间和地形变化。中国光学学报,2000;17(3):538-44 .[PubMed]
25.李b.b.等人。水平细胞揭示了灵长类视网膜锥体类型的特异性适应。中国科学(d辑:自然科学版)1999;[PubMed]
26.Verweij J.等。猕猴视网膜H1水平细胞杆信号的敏感性和动态。视觉杂志1999;39(22):3662 - 72。[PubMed]
27.一个mmermüller J. et al.对海龟视网膜水平细胞的紫外线敏感输入。中华神经科学杂志1998;10(5):1544-52。[PubMed]
28.山田东,石川东。视网膜:某些脊椎动物视网膜中水平细胞的精细结构冷泉港生物学杂志1965;30:383-92。[PubMed]
29.Boycott, B.B. and J.E. Dowling,灵长类动物视网膜的组织:光学显微镜。菲尔。反式。r . Soc。,B1969255: 109 - 184页。
30.Boycott B.B., Peichl L., Wässle H.家猫视网膜水平细胞的形态类型。生物学报,1978;203(1152):229-45 .[PubMed]
31.C一个jal, S.,视网膜的结构在:Thorpe SA, Glickstein M,译者(1972)。1892年,斯普林菲尔德:托马斯。
32.加利西亚人。水平细胞的比较研究及小胶质细胞的注释.视网膜研究进展。1986;5:165-206。
33.Kolb H.灵长类动物视网膜外丛状层的组织:高尔基细胞的电子显微镜。皇家学会哲学汇刊,伦敦,B. 1970; 258:261-283。
34.Kolb H., Mariani A., Gallego A.猴子视网膜上的第二种水平细胞。中华神经科杂志1980;189(1):31-44。[PubMed]
35.马里亚尼a.p.,勒乌-杜普利A.E.鸽子视网膜的水平细胞。中华神经科杂志,1977;175(1):13-26。[PubMed]
36.里柏H.F.海龟视网膜的水平细胞。一、高尔基体制剂的光学显微镜。中华神经科学杂志1978;182(4 Pt 2): 777-93。[PubMed]
37.李艳年,松井金彦,道林金荣斑马鱼视网膜水平细胞-光感受器连接的特异性。中华神经科学杂志2009;516(5):442-53。[PubMed]
38.佩希尔,L., D.桑德曼,B.B.抵制,编。哺乳动物水平细胞的比较解剖与功能.《视网膜的发展与组织》,L.M.查鲁帕和B.L.最后著,1998年,静压出版社:纽约。
39.波里亚克,S.L。,视网膜1941年,芝加哥:芝加哥大学。
40.Sandmann D, Boycott b.b., Peichl L。马和其他马科动物视网膜中的蓝锥水平细胞。J >。1996;16(10):3381 - 96。[PubMed]
41.宋丕义,松井金井,道林J.E.成年斑马鱼视网膜中发现的水平细胞的形态类型和连通性。J Comp Neurol.2008; 506(2): 328 - 38。[PubMed]
42.Stell W.K.等人。金鱼视网膜:锥体水平细胞树突和突触的功能极化。科学。1975;190(4218):989 - 90。[PubMed]
43.斯特尔·沃克,莱特福特金鱼视网膜中视锥细胞和水平细胞的颜色特异性相互联系。中华神经科学杂志,1975;159(4):473-502 .[PubMed]
44.Wässle H.,黎曼H.J.视网膜:哺乳动物视网膜上神经细胞的镶嵌中华生物学报(自然科学版)1978;29(5):561 - 561。[PubMed]
45.K一个neko A., Yamada M.鲤鱼暗适应视网膜中的s电位。杂志。1972;227(1):261 - 73。[PubMed]
46.冢本英,山田英,金子英。杆驱动水平细胞的形态学和生理学研究,特别涉及它们是否有轴突和轴突终末的问题。中华神经科学杂志1987;255(2):305-16。[PubMed]
47.Cuenca N., Haverkamp S., Kolb H.胆碱乙酰转移酶存在于甲鱼视网膜中标记GABA、一氧化氮合酶和钙结合蛋白的水平细胞末端。大脑研究》2000;878(2):228 - 39。[PubMed]
48.Wässle H.,抵制B.B.哺乳动物视网膜的功能结构。杂志启;1991 71(2):447 - 80。[PubMed]
49.Wässle H.,抵制b.b.,罗伦贝克J。猴子视网膜中的水平细胞:锥体连接和树突网络。中华神经科学杂志,1989;1(5):421-435。PubMed]
50.Marc右眼用通道-有机阳离子定位脊椎动物视网膜中的谷氨酸驱动。中华神经科学杂志1999;407(1):47-64。[PubMed]
51.Marc R.E.等人。金鱼视网膜中的gaba能通路。中华神经科学杂志1978;182(2):221-44。[PubMed]
52.里柏H.F.海龟视网膜的水平细胞。2用光镜分析光感受器细胞与水平细胞之间的相互联系。中华神经科学杂志1978;182(4 Pt 2): 795-809。[PubMed]
53.西蒙E.J.龟视网膜上的两种光度水平细胞。杂志。1973;230(1):199 - 211。[PubMed]
54.一个hnelt P.K. et al.猫科动物视网膜的不规则s锥镶嵌。交叉相关发现与无轴突水平细胞的空间相互作用。中国光学学报(自然科学版)2000;17(3):580-8。[PubMed]
55.米勒W.H.等人。龟视网膜L型和c型s电位的生理和形态学鉴定。视觉杂志1973;13(2):443 - 7。[PubMed]
56.于Lipetz,艾德。鲤视网膜外丛状层的功能模型。视觉科学前沿。1978,Springer-Verlag:柏林-海德堡。页471 - 482。
57.雷诺·j·p,拉维奥莱特j·r,瓦格纳h·j金鱼视网膜:无性系蒂中锥体活性与水平细胞形态的相关性。Science.1979; 204(4400): 1436 - 8。[PubMed]
58.魏勒,瓦格纳鲤鱼视网膜锥体-水平细胞相互作用的光依赖性变化。大脑研究》1984;298(1):1 - 9。[PubMed]
59.Schultz K.等人。钙结合蛋白Caldendrin和CaMKII分布在鲤鱼视网膜的小刺中。中华神经科学杂志2004;479(1):84-93。[PubMed]
60.Münz H.等。黄体生成素释放激素(LHRH)-免疫反应性端脑神经元对长骨鱼类视网膜的离心性神经支配。细胞组织学报,1982;222(2):313-23。[PubMed]
61.Stell W.K.等人。金鱼末梢神经:一种黄体生成素释放激素和软体动物心兴奋肽免疫反应嗅觉视网膜通路。中国科学(d辑:自然科学版)1984;[PubMed]
62.DeJuan J., Garcia M.视网膜水平细胞中的棘小体和线虫:一个“棘手”的问题。Brain Res. 2001; 131:519-37。[PubMed]
63.朱克·c.l.,道林·J.E.硬骨鱼视网膜多巴胺能丛状细胞上的离心纤维突触。大自然。1987;330(6144):166 - 8。[PubMed]
64.Pottek M., Weiler R.。视黄酸对视网膜水平细胞感受野特性的光适应效应。中华神经科学杂志2000;12(2):437-45。[PubMed]
65.维勒R.等。视黄酸对视网膜水平细胞具有光适应作用。中国科学(d辑:自然科学版)1998;[PubMed]
66.K一个neko A.角鲨视网膜水平细胞之间的电连接。杂志。1971;213(1):95 - 105。[PubMed]
67.米尔斯s.l.,梅西S.C.神经生物素染色的A型和b型水平细胞在兔视网膜中的分布和覆盖。Vis > 1994; 11(3): 549 - 60。PubMed]
68.J一个nssen-Bienhold U. et al.水平细胞间间隙连接的分子多样性。2001; 131:93-107。[PubMed]
69.麦克马洪d.g.,纳普a.g.,道林J.E.水平细胞间隙连接:单通道电导和多巴胺调节。中国科学(d辑:自然科学版);2011;38(6):669 - 669。[PubMed]
70.J一个nssen-Bienhold U. et al.Connexin57在小鼠水平细胞的树突-树突和轴突-轴突间隙连接中表达,其分布受光调节。中华神经科学杂志2009;513(4):363-74。[PubMed]
71.O 'Brien J.J.等人。兔视网膜中a型水平细胞间的偶联是由连接蛋白50间隙连接介导的。J > 2006; 26(45): 11624 - 36。PubMed]
72.希尔兹等人。斑马鱼视网膜水平细胞特异性启动子活性及连接蛋白52.6和连接蛋白55.5的蛋白表达。J Comp Neurol.2007; 501(5): 765 - 79。[PubMed]
73.Klaassen L.J. et al.由于连接蛋白半通道的缺失,从水平细胞到锥细胞的突触传递受到损害。公共科学图书馆杂志。2011;9 (7):e1001107。[PubMed]
74.米尔斯s.l.,梅西S.C.一系列生物素化示踪剂可以区分视网膜上的三种缝隙连接。J >。2000;20(22):8629 - 36。[PubMed) 7
5.戈德史密斯T.H.蜂鸟能看到近紫外光。科学。1980;207(4432):786 - 8。[PubMed]
76.戈德史密斯T.H.鸟类所看到的。科学美国人。2006;295(1):69 - 75。
77.Harosi f。i。桥本Y。脊椎动物的紫外线视觉色素:一种四色锥体系统。科学。1983;222(4627):1021 - 3。[PubMed]
78.Hughes A.等。锥对斑马鱼ERG的光光谱灵敏度的贡献。Vis > 1998; 15(6): 1029 - 37。[PubMed]
79.Robinson J.等。斑马鱼紫外线视觉色素:吸收光谱、序列和定位。中国科学(d辑:自然科学版)1993;29 (3):369 - 371 .[PubMed]
80.斯瓦蒂钦·G·麦克尼科尔·E.F. Jr。彩色和消色差视觉的视网膜机制。中国科学(d辑:自然科学版)。[PubMed]
81.帕尔曼一世,诺曼龟视网膜中发光型水平细胞的短波输入。视觉研究》1979;19(8):903 - 6。[PubMed]
82.鲁多克·k·h,斯瓦伊钦·G。持续光刺激对硬骨鱼视网膜s电位的影响。杂志。1975;244(3):569 - 88。PubMed]
83.一个mmermüller J., Kolb H.海龟内视网膜的组织。一、ON和off中心路径。中华神经科学杂志1995;358(1):1 - 34。[PubMed]
84.一个mmermüller J., Kolb H.乌龟视网膜的功能结构。视网膜与眼科学进展。1996;15(2):393-433。
85.一个si H., Perlman I.龟视网膜锥体光感受器与水平细胞的神经相互作用。Vis > 1998; 15(1): 1-13。PubMed]
86.K一个mermans, M. and H. Spekreijse,硬骨鱼视网膜内锥驱动水平细胞的光谱行为,在视网膜与眼睛研究进展N. Osborne和G. Chader,编辑,1995,Elsevier Science Ltd. p. 313-360。
87.Kolb, H. and L.E. Lipitz, eds.视网膜:脊椎动物视网膜上颜色视觉的解剖学基础《视觉与视觉功能障碍》。卷。6。1991,麦克米伦出版社:伦敦,128-145。
88.斯佩克瑞杰斯·H,诺顿·A.L.彩色编码s势的动态特性。中国生物医学工程学报(英文版)。[PubMed]
89.斯通,威特科夫斯基,舒特。爪蟾视网膜上的一个彩色水平细胞:细胞内染色和突触药理学。J Neurophysiol.1990; 64(6): 1683 - 94。[PubMed]
90.崔格·格,列维·H,帕尔曼。Turtle c型水平细胞充当推挽装置。Vis > 2001; 18(6): 893 - 900。[PubMed]
91.崔格·格,列维·H,帕尔曼。龟(Mauremys caspica)视网膜c型水平细胞的空间-色相互作用Vis > 2002; 19(1): 71 - 84。PubMed]
92.崔格·格,列维·H,帕尔曼。脊椎动物视网膜水平细胞的颜色对抗。视网膜眼科研究进展,2003;22(1):31-68。[PubMed]
93.Twig G, Perlman I。龟视网膜中颜色对立水平细胞的同质性和多样性:潜在波长辨别的结果。J Vis.2004; 4(5): 403 - 14所示。[PubMed]
94.Yazulla年代。龟视网膜水平细胞的锥输入。视觉杂志1976;16(7):727 - 35。[PubMed]
95.Gottesman J., Burkhardt D.A.弓鳍鱼视网膜c型水平细胞的响应特性。视觉杂志1987;27(2):179 - 89。[PubMed]
96.桥本等人。鲤类视网膜颜色编码系统中的紫外线敏感锥体。神经科学杂志1988;8:S81-95。[PubMed]
97.Zana Y.等。四色输入海龟水平细胞。Vis > 2001; 18(5): 759 - 65。[PubMed]
98.纳尔逊R.F,辛格拉N。斑马鱼视网膜电图中分离信号元件的光谱模型。Vis > 2009; 26(4): 349 - 63。[PubMed]
99.斯坦伯格右猫视网膜s电位的杆-锥相互作用。视觉杂志1969;9(11):1331 - 44。[PubMed]
One hundred.尼尔森·R。cat水平细胞的光谱特性。神经科学杂志,1985;2(83):S167-83。[PubMed]
101.一个hnelt P., Kolb H.灵长类动物视网膜的水平细胞和锥状光感受器:光谱连通性的高尔基光显微镜研究。J Comp Neurol.1994; 343(3): 387 - 405。[PubMed]
102.一个hnelt P., Kolb H.人类视网膜中的水平细胞和锥体光感受器:光谱连通性的高尔基电子显微镜研究。J Comp Neurol.1994; 343(3): 406 - 27所示。[PubMed]
103.Kolb H.猫视网膜外丛状层的组织:电子显微镜观察。J Neurocytol。1977;6(2):131 - 53年。[PubMed]
104.Raviola E.,吉鲁拉N.B.视网膜外丛状层中特殊接触的膜内组织。猴子和兔子的冻裂研究。细胞生物学杂志,1975;65(1):192-222。[PubMed]
105.夏普有限公司,斯托克曼A。杆状通道:什么都看不到的重要性。趋势> 1999;22(11):497 - 504。[PubMed]
106.史密斯r.g.,弗里德m.a.,斯特林P。暗适应猫视网膜的微电路:杆锥网络的功能结构。J > 1986; 6(12): 3505 - 17。PubMed]
107.英镑,P。视网膜,在大脑的突触组织, G.M.谢泼德,编辑,1990,牛津大学出版社:纽约。p . 170 - 213。
108.斯托克曼等人。人类视杆视觉系统中的慢速和快速通路:电生理学和精神物理学。beplay体育公司中国科学(d辑:自然科学版)。PubMed]
109.梅西南加州,米勒R.F.兔视网膜内杆状和锥状驱动水平细胞的兴奋性氨基酸受体。J Neurophysiol。1987;57(3):645 - 59。PubMed]
110.里珀·h·f,哥本哈根博士龟裂龟视网膜水平细胞的杆锥混合反应。视觉杂志1979;19(4):407 - 12所示。[PubMed]
111.威特科夫斯基,斯通,麦克唐纳爪蟾视网膜内富含酶的轴突水平细胞的形态和突触连接。J Comp Neurol.1988; 275(1):第29 ~。[PubMed]
112.威特科夫斯基,斯通。杆状和锥体输入到爪蟾视网膜的双极和水平细胞。视觉杂志1983;23(11):1251 - 8。[PubMed]
113.Cervetto L., Piccolino M.龟视网膜中光感受器与水平细胞之间的突触传递。科学。1974;183(123):417 - 9。[PubMed]
114.Dowling J.E., Ripps H.镁对滑冰视网膜水平细胞活性的影响。大自然。1973;242(5393):101 - 3。[PubMed]
115.K一个neko A., Shimazaki H.外源离子对鲤鱼视网膜感光细胞向水平细胞突触传递的影响。J Physiol.1975; 252(2): 509 - 22所示。[PubMed]
116.Bloomfield S.A., Dowling J.E.天冬氨酸和谷氨酸在兔视网膜突触传递中的作用。一、外丛状层。53 J Neurophysiol。1985;(3):699 - 713。[PubMed]
117.Cervetto L., MacNichol E.F. Jr.谷氨酸和天冬氨酸对龟视网膜水平细胞的失活作用。科学。1972;178(62):767 - 8。[PubMed]
118.马歇尔·l.m.,维尔布林·F.S.虎蝾螈幼体视网膜水平细胞的突触传递。杂志。1978;279:321-46。[PubMed]
119.根岸K,德鲁扬B.D.某些氨基酸对鱼视网膜水平细胞的影响。神经科学杂志,1979;4(5-6):351-63。[PubMed]
120.诺曼,帕尔曼,戴利l -天冬氨酸和l -谷氨酸持续融合对龟视网膜水平细胞的影响。视觉Res.1986; 26(2): 259 - 68。[PubMed]
121.Eliasof S. et al.5个克隆自蝾螈视网膜的谷氨酸转运蛋白的定位和功能。视觉研究》1998;38(10):1443 - 54。[PubMed]
122.Rauen T.等人。大鼠视网膜高亲和力谷氨酸转运体:胶质谷氨酸转运体GLAST-1在递质清除中的主要作用。细胞组织学报1998;291(1):19-31。[PubMed]
123.杨小林,吴思明视网膜双极细胞前馈侧抑制:水平细胞去极化双极细胞突触的输入输出关系。中国科学(d辑:自然科学版)1991;29(3):369 - 369。[PubMed]
124.梅耶m.l.,威斯布鲁克G.L.脊椎动物中枢神经系统中兴奋性氨基酸的生理学。食物一般。1987;28(3):197 - 276。[PubMed]
125.拉萨特·e·m,道林·j·e培养的鲤鱼水平细胞对l -谷氨酸及其激动剂有选择性的反应。中国科学(d辑:自然科学版),2002;29(3):369 - 369。PubMed]
126.哈尔斯·g等。从鲶鱼视网膜上分离的水平细胞上谷氨酸和一些谷氨酸类似物产生的电流的电压钳分析。J Neurophysiol。1986;胜38负(1):56。[PubMed]
127.帕尔曼一世,纳普a.g.,道林J.E.离体白鲈水平细胞对光感受器递质激动剂浓度变化的响应。第16 - 25大脑研究》1989;487(1):。[PubMed]
128.立花。l -谷氨酸诱导鲫鱼视网膜水平细胞通透性的改变。杂志。1985;358:153 - 67。PubMed]
129.彭玉文等。谷氨酸受体亚型在脊椎动物视网膜中的分布。神经科学。1995;66(2):483 - 97。[PubMed]
130.吴克里视网膜外突触传递。物理学报1994;56:41 - 68。[PubMed]
131.奥戴尔t.j.,克里斯滕森B.N.从鲶鱼视网膜上分离的水平细胞含有两种兴奋性氨基酸受体。J Neurophysiol。1989;61(6):1097 - 109。[PubMed]
132.Eliasof S., Jahr C.E.鲶鱼锥体水平细胞AMPA受体的快速脱敏。Vis > 1997; 14(1): 13-8。[PubMed]
133.施米特·k·f,克鲁泽·M,哈特·H。多巴胺改变鲈鱼视网膜水平细胞中的谷氨酸受体脱敏。中国科学(d辑:自然科学版)1994;[PubMed]
134.Blanco R., de la Villa P.兔视网膜离体水平细胞中的谷氨酸离子受体。中华神经科学杂志1999;11(3):867-73。[PubMed]
135.沈燕,陆涛,杨小林刀豆蛋白A、环噻嗪、阿尼拉西坦和PEPA对离体鲫鱼水平细胞谷氨酸受体脱敏的调节作用。神经科学。1999;89(3):979 - 90。[PubMed]
136.杨建华等。虎蝾螈视网膜水平细胞的突触后反应是由ampa偏好受体介导的。大脑Res.1998; 797(1): 125 - 34。[PubMed]
137.沈伟,芬尼根s.g.,斯劳特M.M.人视网膜水平细胞谷氨酸受体亚型。Vis > 2004; 21(1): 89 - 95。[PubMed]
138.Dixon D.B., Copenhagen D.R.代谢性谷氨酸受体介导的内向整流电流抑制通过cGMP级联连接。J Neurosci.1997; 17(23): 8945 - 54。[PubMed]
139.Linn c.l., Gafka A.C.在硬骨鱼水平细胞中,代谢性谷氨酸受体的激活调节电压门控的持续钙电流。J Neurophysiol。1999;81(2):425 - 34。[PubMed]
140.高桥K.I.,哥本哈根博士细胞内pH值对神经元功能的调节。> > 1996; 24(2): 109 - 16。[PubMed]
141.D一个vis S.F., Linn C.L.视网膜远端NMDA受体激活与电压门控钠电流调制的机制。中国生物医学工程学报,2003;29(5):369 - 369。[PubMed]
142.尼尔森·R,本德·上午,康诺顿副总裁钠泵刺激恢复斑马鱼视网膜远端谷氨酸刺激神经元的膜电位。杂志。2003;549(3):787 - 800。[PubMed]
143.拉萨特。从白栖鱼视网膜分离的水平细胞培养的离子电流。55 J Neurophysiol。1986;(3):499 - 513。[PubMed]
144.拉萨特。硬骨鱼视网膜水平细胞中半角酸盐和钾酸盐激活的单通道特征。视觉杂志1991;31(3):413 - 24。[PubMed]
145.洛尔克,霍夫曼兔视网膜单层培养中A型和b型水平细胞的电压门控电流。Vis > 1994; 11(2): 369 - 78。PubMed]
146.上田Y,金子A,金田M。从猫视网膜分离的水平细胞中电压依赖性离子电流。J Neurophysiol。1992;68(4):1143 - 50。PubMed]
147.立花。从金鱼视网膜分离的水平细胞的离子电流。杂志。1983;345:329-51。[PubMed]
148.新盖R,克里斯滕森B.N.从鲶鱼视网膜分离的水平细胞的可兴奋性和电压敏感离子电导。J Neurophysiol。1986;56(1):32-49。[PubMed]
149.Malchow R.P.等人。滑冰视网膜两种水平细胞的结构和功能特性。中华医学杂志1990;95(1):177-98。[PubMed]
150.戈拉德,威特科夫斯基,特兰华。龟视网膜水平细胞的膜电流。J Neurophysiol。1992;68(2):351 - 61。[PubMed]
151.Pfeiffer-Linn c.l., Perlman I., Lasater E.M.从白鲈鱼视网膜分离出来的水平细胞内钾整流的钠依赖性。大脑Res.1995; 701(1 - 2): 81 - 8。[PubMed]
152.帕尔曼一世,苏利文j.m.,诺曼R.A.电压和时间依赖性钾导增强了龟视网膜水平细胞的频率响应。大脑研究》1993;619(2):89 - 97。[PubMed]
153.立花。金鱼视网膜孤立水平细胞的膜特性。杂志(Lond)。1981; 321:141 - 61。[PubMed]
154.沙利文·j·m,拉萨特·e·m一种异常小的钾电流,非常适合长期去极化的视网膜神经元。大脑Res.1990; 528(1): 130 - 2。[PubMed]
155.一个kopian A., Krizaj D., Witkovsky P.高电压和低电压激活的钙电流都对爪蟾视网膜的光度水平细胞的光诱发反应有贡献。大脑研究》1997;762(2):121 - 30。[PubMed]
156.K一个mermans M., Werblin F.gaba介导的正自反馈回路控制虎蝾螈视网膜的水平细胞动力学。J > 1992; 12(7): 2451 - 63。[PubMed]
157.钱宏,杜林来自棒驱动的视网膜水平细胞的新的GABA反应。大自然。1993;361(6408):162 - 4。[PubMed]
158.Blanco R., Vaquero C.F., de la Villa P.GABA和甘氨酸对兔视网膜水平细胞的影响。视觉杂志1996;36(24):3987 - 95。[PubMed]
159.C一个mmack J.N., Schwartz E.A.鲶鱼视网膜水平细胞对伽马氨基丁酸的电致转运所需的离子。杂志。1993;472:81 - 102。PubMed]
160.Dong C.J., Picaud S.A., Werblin F.S.氨基丁酸转运体和氨基丁酸C类似于鲶鱼锥状细胞上的受体,而不是杆状细胞驱动的水平细胞。神经科学杂志1994;14(5 Pt 1): 2648-58。[PubMed]
161.Malchow r.p., Ripps H。-氨基丁酸对滑板视网膜水平细胞的影响:电致摄取机制的证据。中国科学(d辑:自然科学版)1990;29(3):369 - 369。[PubMed]
162.尼尔森·R,本德·上午,康诺顿副总裁斑马鱼视网膜水平和双极细胞中转运体介导的GABA反应。Vis Neurosci.2008; 25(2): 155 - 65。[PubMed]
163.Kolb H., West R.W.猫视网膜内丛状细胞的突触连接。J Neurocytol。1977;6(2):155 - 70。[PubMed]
164.威特科夫斯基,道林鲤鱼视网膜丛状层的突触关系。中国科学(d辑:自然科学版)。[PubMed]
165.汉普森E.C,维勒R,范尼d.i哺乳动物视网膜水平细胞间隙连接的ph门控多巴胺能调节。中国生物科学1994;255(1342):67-72。[PubMed]
166.寺西真,根岸真,加藤顺。多巴胺调节鲤鱼视网膜外水平细胞间s电位振幅和染料偶联。Nature.1983; 301(5897): 243 - 6。[PubMed]
167.羔羊杰龟视网膜水平细胞反应的空间特性。杂志。1976;263(2):239 - 55。[PubMed]
168.Nelson R, Pflug R, Baer S.M.背景诱导的猫视网膜水平细胞闪烁增强。2空间属性。J Neurophysiol。1990;64(2):326 - 40。PubMed]
169.K一个mermans M. et al.光适应金鱼视网膜中水平细胞感受野的大小与刺激相适应。视觉杂志1996;36(24):4105 - 19。PubMed]
170.Lankheet m.j., Frens m.a., van de Grind W.A.猫视网膜水平细胞反应的空间特性。视觉杂志1990;30(9):1257 - 75。[PubMed]
171.Hare W.A, Owen W.G.虎蝾螈视网膜两极细胞感受野的空间组织。杂志。1990;421:223-45。[PubMed]
172.帕尔曼等人。鳖视网膜红锥细胞和l型水平细胞对彩色和空间信息的处理。视觉研究》1985;25(4):543 - 9。PubMed]
173.皮科利诺M,内顿J.,格申菲尔德H.。龟视网膜小视场光度水平细胞的中心-周围拮抗组织。J Neurophysiol.1981; 45(3): 363 - 75。[PubMed]
174.Byzov A.L., Shura-Bura T.M.龟视网膜中沿水平细胞网络的电位扩散。视觉杂志1983;23(4):389 - 97。[PubMed]
175.Borenstein, O.,龟视网膜水平细胞层中电信号的横向传播1999年,以色列理工学院:海法。
176.帕尔曼一世,Ammermüller。龟视网膜L1水平细胞的受体场大小:多巴胺和背景光的影响。J Neurophysiol.1994; 72(6): 2786 - 95。[PubMed]
177.波泰克M,舒尔茨K,维勒R。一氧化氮对鲤鱼视网膜水平细胞网络和多巴胺释放的影响。视觉研究》1997;37(9):1091 - 102。PubMed]
178.K一个to S.c型水平细胞对环形刺激的反应。Exp Eye Res. 1979;28(6): 627-39。[PubMed]
179.麦克马洪D.G.斑马鱼视网膜水平细胞电突触传递的调节。神经科学杂志1994;14(3 Pt 2): 1722-34。[PubMed]
180.B一个ylor D.A., Fuortes M.G., O’Bryan P.M.海龟视网膜上的视锥细胞接受区。杂志。1971;214(2):265 - 94。[PubMed]
181.Burkhardt D.A.栖木视网膜视锥细胞的反应与受体场组织。J Neurophysiol。1977;40(1):53 - 62。[PubMed]
182.Fuortes M.G., Schwartz E.A., Simon E.J.龟视网膜视锥反应的颜色依赖性。杂志。1973;234(1):199 - 216。[PubMed]
183.Lasansky。虎蝾螈幼体视网膜对环形照明的锥反应的突触作用。杂志。1981;310:205-14。[PubMed]
184.下午的奥布赖恩龟视网膜视锥细胞外周光照诱发去极化突触电位的特性。杂志。1973;235(1):207 - 23。PubMed]
185.Packer O.S.等。灵长类S锥光感受器中的蓝黄色对手。J >。2010;30(2):568 - 72。[PubMed]
186.吴克里虎蝾螈视网膜水平细胞与视锥细胞反馈突触的输入输出关系。J Neurophysiol。1991;65(5):1197 - 206。[PubMed]
187.伊扎基A,马利克S,帕尔曼I。龟视网膜中短波(蓝)视锥的光谱特性。Vis > 1992; 9(3 - 4): 235 - 41。[PubMed]
188.Witkovsky P.等。来自光度水平细胞的反馈调节了色度水平细胞的去极化反应。中国科学(d辑:自然科学版)1995;[PubMed]
189.K一个mermans M. et al.视网膜外半通道介导的抑制。科学。2001;292(5519):1178 - 80。[PubMed]
190.林伯格(Linberg k.a.),费希尔(Fisher S.K.视网膜水平细胞轴突终末是突触前的超微结构证据。中华神经科学杂志,1988;268(2):281-97 .[PubMed]
191.平野A.A.等。哺乳动物水平细胞过程中syntaxin-4免疫反应性强。Vis > 2007; 24(4): 489 - 502。[PubMed]
192.Cueva J.G. et al.泡状-氨基丁酸转运蛋白在无分泌细胞和水平细胞中的表达。中华神经科学杂志2002;445(3):227-37。[PubMed]
193.Djamgoz M.B., Kirsch M., Wagner H.J.氟哌啶醇抑制光诱导的鱼(蟑螂)视网膜水平细胞棘突形成和双相反应。>。1989;107(1 - 3):200 - 4。[PubMed]
194.Downing J.E., Djamgoz M.B.鲤类鱼视网膜锥体光感受器-水平细胞连接模式的定量分析:功能鉴定和酶标水平细胞的电子显微镜。中华神经科学杂志1989;289(4):537-53。[PubMed]
195.瓦格纳H.J.鱼视网膜锥体蒂水平细胞末端形态的光依赖性可塑性。J Neurocytol。1980;9(5):573 - 90。[PubMed]
196.Kirsch M., Djamgoz M.B., Wagner H.G.鲤类鱼视网膜中水平细胞光谱响应的棘突动力学和可塑性的相关性:定量分析。细胞与组织研究。1990;260(1):123-130。
197.Connaughton V.P. et al.斑马鱼视网膜兴奋性和抑制性神经递质的免疫细胞化学定位。Vis >。1999;16(3):483 - 90。PubMed]
198.亚祖拉。视网膜水平细胞中GABA的载体介导释放。大脑研究》1983;263(1):63 - 75。[PubMed]
199.立bana M, Kaneko A。-氨基丁酸作用于龟光感受器的轴突末端:不同细胞类型的敏感性差异。中国科学(d辑:自然科学版)1984;[PubMed]
200.Tatsukawa T.等龟视网膜视锥细胞反馈反应中的gaba介导成分。Vis > 2005; 22(3): 317 - 24。[PubMed]
201.村上等。gaba介导的鲤鱼视网膜负反馈和颜色对抗。中华化学杂志。1982;32(6):927-35。[PubMed]
202.村上等。氨基丁酸介导鲤鱼视网膜水平细胞对视锥细胞的负反馈。中华化学杂志。1982;32(6):911-26。[PubMed]
203.帕尔曼一世,诺曼GABA及相关药物对离体龟视网膜水平细胞的影响。Vis >。1990;5(5):469 - 77。[PubMed]
204.魏伟杰,霍恩斯坦,施纳夫,J.L.猕猴锥体光感受器的周围拮抗作用。J > 2003; 23(32): 10249 - 57。[PubMed]
205.Verweij J.等。金鱼视网膜光谱分类水平细胞GABA敏感性的研究。Vis > 1998; 15(1): 77 - 86。[PubMed]
206.平泽H, Kaneko A。内陷突触间隙的pH值变化通过调节钙离子介导水平细胞向锥状光感受器的反馈2 +频道。中国生物医学工程学报,2003;22(6):657-71。[PubMed]
207.B一个b一个i N., Thoreson W.B.水平细胞反馈调节蝾螈和小鼠视网膜视杆感光器的钙电流和细胞内钙水平。中国生物医学工程学报,2009;36(5):369 - 369。[PubMed]
208.C一个detti L., Thoreson W.B.同时记录研究了水平细胞膜电位对锥状钙电流的反馈效应。J Neurophysiol。2006;95(3):1992 - 5。[PubMed]
209.D一个venport C.M., Detwiler P.B., Dacey D.M.pH缓冲对灵长类视网膜水平和神经节细胞光反应的影响:围绕形成的质子假说的证据。J >。2008;28(2):456 - 64。[PubMed]
210.托雷森,巴拜,巴托莱蒂脊椎动物视网膜中水平细胞对视杆感光器的反馈。J >。2008;28(22):5691 - 5。[PubMed]
211.特伦霍姆,鲍德里奇氨基磺酸缓冲液对金鱼视网膜水平细胞光响应和细胞内pH值的影响。J Neurochem.2009; 115(1): 102 - 11所示。[PubMed]
212.维西j·p等人。质子介导的锥光感受器突触前钙通道的反馈抑制。J > 2005; 25(16): 4108 - 17。PubMed]
213.F一个hrenfort I. et al.脊椎动物视网膜中水平细胞向视锥细胞的半通道介导和ph值为基础的反馈。《公共科学图书馆•综合》。2009;4 (6):e6090。[PubMed]
214.Kreitzer M.A. et al.去极化和谷氨酸对鲶鱼视网膜水平细胞胞外质子通量的调节。创Physiol.2007; 130(2): 169 - 82。[PubMed]
215.魏伟杰,卡默曼斯M.,斯佩克瑞斯H.。水平细胞通过改变锥体钙电流激活范围反馈给锥体。视觉Res.1996; 36(24): 3943 - 53。[PubMed]
216.K一个mermans M., Fahrenfort I.化学突触内的表观相互作用:视网膜中半通道介导的表观抑制。当今Neurobiol.2004; 14(5): 531 - 41。[PubMed]
217.维科夫斯基P,加布里埃尔R,克里扎伊D。小鼠和大鼠视网膜多巴胺能丛状突起的解剖学和神经化学特征。中华神经科杂志2008;510(2):158-74。[PubMed]
218.Witkovsky P。多巴胺和视网膜功能。医生角膜切削。2004;108(1):17-40。[PubMed]
219.Dong C.J., McReynolds J.S.泥鳅视网膜中光、多巴胺释放和水平细胞偶联的关系。杂志。1991;440:291 - 309。[PubMed]
220.曼格尔s.c.,道林J.E.鲤鱼水平细胞的反应性和感受野大小被延长的黑暗和多巴胺减少。Science.1985; 229(4718): 1107 - 9。[PubMed]
221.M.皮克利诺,J.内顿,h .格申菲尔德多巴胺和3 ':5 ' -单磷酸环腺苷诱导龟视网膜水平细胞缝隙连接通透性降低。J > 1984; 4(10): 2477 - 88。[PubMed]
222.张爱军,Jacoby R,吴思明灵长类水平细胞的光和多巴胺调节的感受野可塑性。中华神经科学杂志。2011;519(11):2125-34 .[PubMed]
223.Dowling J.E.视网膜神经调节:多巴胺的作用。Vis > 1991; 7(1 - 2): 87 - 97。[PubMed]
224.他S,维勒R,范尼d哺乳动物视网膜水平细胞偶联的内源性多巴胺能调节。中华神经科学杂志,2000;418(1):33-40 .[PubMed]
225.Reitsamer H.A.等人。哺乳动物视网膜水平细胞轴突末端感受野大小的多巴胺能调节。视觉研究》2006;46(4):467 - 74。PubMed]
226.钱浩,里普斯。鳐视网膜中杆驱动水平细胞的感受野特性。中国生物医学工程学报,1992;20(3):457-78。[PubMed]
227.麦克马洪d.g.,布朗D.R.斑马鱼视网膜电突触间隙结通道门控的调节。J Neurophysiol。1994;72(5):2257 - 68。[PubMed]
228.DeVries S.H., Schwartz E.A.多巴胺和第二信使对鲶鱼水平细胞间电突触的调节。杂志。1989;414:351 - 75。[PubMed]
229.维勒R.等。谷氨酸和多巴胺调节鱼视网膜水平细胞树突突触可塑性。>。1988;87(3):205 - 9。[PubMed]
230.杨小林,李志强,李志强硬骨鱼视网膜锥体水平细胞活性的调节。2互丛状细胞和多巴胺在调节光反应中的作用。J > 1988; 8(7): 2269 - 78。[PubMed]
231.Knapp A.G., Dowling J.E.多巴胺增强培养的视网膜水平细胞的兴奋性氨基酸门控电导。大自然。1987;325(6103):437 - 9。PubMed]
232.施密特K.F.二价阳离子调节河鲈视网膜水平细胞中的谷氨酸受体。>。1999;262(2):109 - 12。PubMed]
233.Pflug R.等。多巴胺能配体对哺乳动物视网膜水平细胞功能的调节。视觉研究》2008;48(12):1383 - 90。[PubMed]
234.曼格尔s.c.,道林J.E.鱼视网膜的互丛-水平细胞系统:多巴胺、光刺激和黑暗时间的影响。中华生物学报(自然科学版)1987;31(6):369 - 369。[PubMed]
235.威特科夫斯基,斯通,贝沙尔斯多巴胺改变了爪蟾视网膜水平细胞的杆状和锥状输入的平衡。大脑研究》1988;449(2):332 - 6。[PubMed]
236.威特科夫斯基,斯通,特兰华。视网膜上的光感受器到水平细胞突触转移:多巴胺配体的调节和杆和锥输入交互作用的电路模型。J Neurophysiol。1989;62(4):864 - 81。[PubMed]
237.内森·C。一氧化氮是哺乳动物细胞的分泌产物。美国实验生物学学会联合会j . 1992; 6(12): 3051 - 64。[PubMed]
238.Koistinaho J., Sagar S.M.光诱导兔视网膜无分泌细胞中c-fos的表达。脑Res Mol Brain Res 1995;29(1): 53-63。[PubMed]
239.Liepe b.a等。蝾螈和鱼视网膜穆勒细胞和神经元中的一氧化氮合酶。J > 1994; 14(12): 7641 - 54。[PubMed]
240.Ostholm T.等人。大西洋鲑鱼中枢神经系统中的一氧化氮合酶。>。1994;168(1 - 2):233 - 7。[PubMed]
241.维勒R,凯维茨B。一氧化氮合酶的标记物NADPH-diaphorase在鲤鱼视网膜的水平细胞和内视网膜细胞中与GABA共定位。>。1993;158(2):151 - 4。[PubMed]
242.哈弗坎普,埃尔德雷德nNOS在龟和大鼠视网膜感光细胞、双极细胞和水平细胞中的定位。Neuroreport。1998;9(10):2231 - 5。PubMed]
243.Haverkamp S, Kolb H, Cuenca N。内皮型一氧化氮合酶(eNOS)存在于所有脊椎动物视网膜的Muller细胞中。视觉杂志1999;39(14):2299 - 303。[PubMed]
244.Haverkamp S, Kolb H, Cuenca N。海龟视网膜中神经元一氧化氮合酶阳性无分泌细胞的形态和神经化学多样性。细胞组织Res. 2000;302(1): 11-9。[PubMed]
245.泽梅尔·e等人。哺乳动物视网膜的NADPH返光酶活性受视觉适应状态的调节。Vis > 1996; 13(5): 863 - 71。[PubMed]
246.泽梅尔·E,雷·B,帕尔曼一世。兔视网膜NADPH返光酶活性受谷氨酸途径的调节。中华神经科学杂志,2001;431(1):28-38 .[PubMed]
247.萨夫琴科,巴恩斯,克莱默环核苷酸门控通道通过一氧化氮介导突触反馈。大自然。1997;390(6661):694 - 8。[PubMed]
248.宫内美,村上美,中木春。精氨酸阻断视网膜水平细胞之间的缝隙连接。Neuroreport。1990;1(2):107 - 10。[PubMed]
249.布卢姆菲尔德律师事务所Xin D一氧化氮对兔视网膜水平细胞的影响。Vis > 2000; 17(5): 799 - 811。[PubMed]
250.吕c,麦克马洪D.G.一氧化氮对杂交鲈鱼视网膜间隙连接通道门控的调节作用。中国生物医学工程学报。1997;499(Pt 3): 689-99。[PubMed]
251.列维·H,特威格·G,帕尔曼I。在环境光照条件的变化中,一氧化氮调节视锥细胞和水平细胞之间的传递函数。中华神经科学杂志2004;20(11):2963-74。[PubMed]
252.冢山Y,诺尔G.N,施密特K.F.l -精氨酸和烟酰胺腺嘌呤二核苷酸磷酸可以改变蛙(Rana temporaria)离体视网膜杆的暗电压和加速光反应恢复。>。1993;149(1):95 - 8。[PubMed]
253.Kurenny D.E. et al.一氧化氮对杆状光感受器离子通道的调节。神经元。1994;13(2):315 - 24。[PubMed]
254.麦克马洪d.g.,波诺玛列娃L.V.一氧化氮和cGMP调节视网膜谷氨酸受体。J Neurophysiol。1996;76(4):2307 - 15所示。[PubMed]
255.Dowling J.E., Wald G.维生素a酸的生物学功能。中国科学(d辑:自然科学版),2000;[PubMed]
256.瓦尔德克。类胡萝卜素和视觉周期。中华医学杂志。1935;19(2):351-71。[PubMed]
257.凯悦G.A.等。视黄酸诱导斑马鱼视网膜的复制。中国科学(d辑:自然科学版)1992;29(3):369 - 369。[PubMed]
258.marshall - armstrong N.等人。视黄酸是斑马鱼腹侧视网膜发育所必需的物质。中国科学(d辑:自然科学版)1994;29 (3):369 - 369 .[PubMed]
259.瓦格纳M,汉B,杰塞尔t。M通过体外报告试验检测胚胎神经组织中类维生素a释放的区域差异。Development.1992; 116(1): 55 - 66。[PubMed]
260.Dräger U.C., McCaffery P.视黄酸与视网膜的发育。视网膜与眼睛研究进展。1997;16(3):323-351。
261.维勒R.等。视黄酸,视网膜中的一种神经调节剂。大脑科学进展,2001;131:309-18。[PubMed]
262.维勒R,何S,范尼d维甲酸调节哺乳动物视网膜水平细胞间缝隙连接的通透性。欧元Neurosci.1999; 11(9): 3346 - 50。[PubMed]
263.王晓明,王晓明。鱼离体视网膜的电反应。Am J Ophthalmol. 1958;46(3 Part 2): 26-40。[PubMed]
264.Chappell R.L., Naka K., Sakuranaga M.海龟水平细胞反应的动力学。中国生物医学工程学报1985;86(3):423-53。[PubMed]
265.Frumkes T.E., Eysteinsson T.远端脊椎动物视网膜的抑制杆锥相互作用:来自爪蟾和Necturus的细胞内记录。J Neurophysiol.1987; 57(5): 1361 - 82。[PubMed]
266.吕弗拉格,尼尔森,阿内特背景诱导的猫视网膜水平细胞闪烁增强。一、时间和光谱特性。J Neurophysiol.1990; 64(2): 313 - 25所示。[PubMed]
267.戈德堡s.h.,弗鲁姆克斯t.e.,尼加德R.W.人类视网膜中未受刺激的视杆的抑制作用:锥闪烁检查提供的证据。Science.1983; 221(4606): 180 - 2。[PubMed]
268.Dowling J.E., Werblin F.S.泥豚视网膜的组织结构。即突触结构。J Neurophysiol。1969;32(3):315 - 38。[PubMed]
269.Frumkes T.E., Eysteinsson T.抑制杆锥相互作用的细胞基础。Vis >。1988;1(3):263 - 73。[PubMed]
270.Dowling J.E.脊椎动物视网膜的组织角膜切削投资。1970;9(9):655 - 80。[PubMed]
271.Kolb H., Jones J.龟视网膜外丛状层的突触组织:连续切片的电子显微镜研究。J Neurocytol.1984; 13(4): 567 - 91。[PubMed]
272.吴克里-氨基丁酸对虎蝾螈视网膜锥体和双极细胞的影响。大脑研究》1986;365(1):70 - 7。[PubMed]
273.瓦尔迪;奥尔巴赫;猫视网膜的特定细胞类型表达不同形式的谷氨酸脱羧酶。中华神经科学杂志1995;351(3):374-84。[PubMed]
274.瓦尔迪,马萨拉契亚,斯特林。免疫反应性,伽马氨基丁酸一个猫视网膜外丛状层的受体。中华神经科学杂志1992;320(3):394-7 .[PubMed]
275.瓦尔迪,斯特林。GABA的亚细胞定位一个猕猴和人视网膜双极细胞受体。视觉研究》1994;34(10):1235 - 46。[PubMed]
276.Vardi N.等人。视网膜神经元中不同的阳离子氯离子共转运体对氨基丁酸有相反的反应。J >。2000;20(20):7657 - 63。PubMed]
277.Bloomfield S.A., Xin D.对哺乳动物所有无分泌细胞的包围抑制产生于视网膜近端。物理学报,2000;523(Pt 3): 771-83。[PubMed]
278.纳尔逊·R,科尔布·H。猫视网膜双极细胞和神经节细胞的突触模式和反应特性。视觉杂志1983;23(10):1183 - 95。[PubMed]
279.一个mmermüller J. et al.水平细胞网络结构对龟外视网膜信号传播的影响。实验和模拟。视觉Res.1996; 36(24): 4089 - 103。[PubMed]
280.一个mmermüller J., Muller J.F., Kolb H.海龟内视网膜的组织。2颜色编码和定向选择细胞的分析。J Comp Neurol.1995; 358(1): 35 - 62。[PubMed]
281.Lasansky。虎蝾螈幼体视网膜内受体与电生理识别神经元之间的接触。杂志。1978;285:531-42。PubMed]
282.马奇亚法瓦p.l.,维勒R。龟视网膜神经节细胞输入组织的细胞内分析和结构相关性。中华生物学报(英文版)1980;208(1170):103-13。[PubMed]
283.纳卡K。鲶鱼视网膜中的神经回路。角膜切削投资。1976;(11):926 - 935。
284.纳卡K.I.脊椎动物视网膜的感受野机制。科学。1971;171(972):691 - 3。[PubMed]
285.齐藤田,近藤华,丰田章。鲤鱼视网膜中两种中心上双极细胞的离子机制。2环形照明的响应。J创Physiol.1981; 78(5): 569 - 89。[PubMed]
286.齐藤腾,近藤弘,丰田纪鲤鱼视网膜中两种中心上双极细胞的离子机制。一、对中心照明的响应。J创Physiol.1979; 73(1): 73 - 90。[PubMed]
287.McReynolds, J.S.和P.D. Lukasiewicz,编。泥狗视网膜神经节细胞中来自通路和通路的突触输入整合。视网膜内神经生物学,R.维勒和N.N.奥斯本主编。H31卷。1989,斯普林格-弗拉格:柏林,海德堡,209-220。
288.民谣钢弦W.K.金鱼视网膜水平细胞树突的功能极化。角膜切削投资。1976;(11):895 - 908。
289.黄锦玉,道林J.E.巨型达尼奥视网膜双极细胞输入机制:III。开-关双极细胞及其颜色对抗机制。J Neurophysiol.2005; 94(1): 265 - 272。[PubMed]
290.甜菜南卡罗来纳州兔视网膜神经节细胞周围感受野水平细胞贡献的分析。杂志。1991;442:211-34。PubMed]
291.魏伟,魏可夫斯基。亚毫微米钴选择性抑制视网膜神经元周围的感受野。Vis >。1999;16(1):159 - 68。[PubMed]
292.Gouras P。贡纳Svaetichin。1915 - 1981。视觉杂志1982;22(3):339 - 40。[PubMed]
293.Kolb H., Perlman I., Normann R.A.龟视网膜的神经组织:光学显微镜和高尔基体研究。Vis Neurosci.1988; 1(1): 47 - 72。[PubMed]
294.Kolb H.猫视网膜水平细胞与光感受器之间的连接:高尔基体制剂的电子显微镜。J Comp Neurol.1974; 155(1): 1 - 14。[PubMed]
295.诺曼·罗,波可布拉斯基。杆状细胞和水平细胞膜电位的振荡:脊椎动物视网膜中杆状细胞反馈的证据。J Physiol.1976; 261(1): 15 - 29。[PubMed]
296.Bloomfield S.A.兔视网膜中具有定向敏感反应特性的水平细胞的一种独特形态亚型。J Comp Neurol.1992; 320(1): 69 - 85。[PubMed]
最后更新于2012年1月。