史蒂夫·费舍尔,杰弗里·p·刘易斯,肯尼斯·A·林伯格,爱德华·巴拉维德和马克·v·维拉多
1.介绍。
什么是视网膜脱离?
视网膜牢固地附着在视网膜色素上皮(RPE)的顶端表面(见前面的视网膜解剖部分)。当视网膜从其相对于RPE表面的正常位置分离时,称为“分离”。这种脱离在神经视网膜和视网膜色素上皮之间形成病态的充满液体的空间。它还使光感受器和它们唯一的血液供应——脉络膜循环之间的距离增大。
临床视网膜脱离有不同的类型
临床上公认的视网膜脱离有三种类型:1)裂孔性这是最常见的一种。在这种形态中,视网膜经历了视网膜层的物理撕裂,撕裂的视网膜由于液体进入视网膜层和视网膜层之间的空隙而远离视网膜色素上皮。2)拖引在这一过程中,某种力量(通常是收缩细胞或玻璃体“链”)作用于视网膜表面,将其从视网膜色素上皮上拉离。3)渗出性在这种情况下,液体在神经视网膜和视网膜色素上皮之间积聚,将两者推开;视网膜组织没有撕裂。
视网膜脱离可导致永久性视力丧失或视力功能永久性下降,特别是如果黄斑受损伤,在美国这种情况被视为医疗紧急情况。有关视网膜脱离的类型和原因的更多信息,请参见美国国家眼科研究所的网站:http://www.nei.nih.gov/health/retinaldetach/index.asp#2
视网膜的细胞重塑
视网膜中已经发现了许多特定的神经回路(Dowling, 1970;Kolb & Famiglieti, 1976;Linberg等,2001b;Kolb et al., 2001),直到最近才有证据发现,成年哺乳动物的这些回路会改变(重塑),通常是对受伤和疾病的反应。在此之前,视网膜被大多数科学家认为是中枢神经系统的“硬连接”部分。电路的改变可能意味着视力的改变,因此了解这些变化以及防止或修复它们的方法是很重要的。
一些视网膜重塑的例子
脊椎动物视网膜细胞重构的少数早期描述来自对鱼类视网膜的研究(Wagner, 1975;瓦格纳和阿里;1977;Wagner, 1980),光感受器和2阶神经元之间的特定突触连接随着每日照明周期的变化而发生结构上的变化。1984年,Peichl和Bolz描述了哺乳动物视网膜神经元的结构重建,以应对神经毒素海肽酸引起的严重视网膜退化。近十年后,关于哺乳动物视网膜细胞重构对损伤或疾病的反应的报道开始有一定规律性地出现(Chu, Humphrey & Constable, 1993, Li等人,1995;Lewis, Linberg & Fisher, 1998, Fariss et al., 2000)。直到那时,甚至光感受器细胞的全部丧失也没有被认为是导致视网膜内部发生重大变化的原因。
光感受器细胞死亡在不同模型中不同
最近许多关于哺乳动物视网膜结构重构的描述来自对人类或啮齿动物的研究,在这些研究中,光损伤或基因突变导致大量感光细胞死亡(Marc et al., 2003年)。视网膜脱离提供了补充这些数据的信息,因为在大多数物种中,脱离后不会有大量的感光细胞死亡。另一个重要的区别是,由脱离引起的最早和最明显的损伤,即外节段变性,可以通过再植视网膜而恢复。视网膜再植手术可能在恢复发生时诱导视网膜回路的重塑,但目前这方面的研究较少。
视网膜脱离和再植作为实验系统
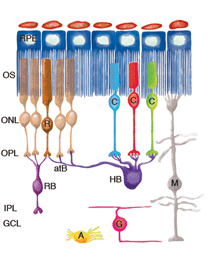
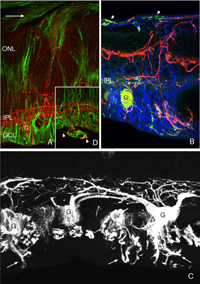
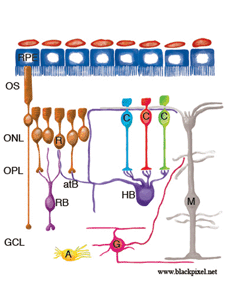
图1显示了分离后观察到的重构细胞类型,包括:RPE、穆勒细胞、光感受器、杆状双极细胞、水平细胞、神经节细胞和星形胶质细胞。似乎在其他类型的细胞中也会发现重构。
在早期研究中,外节段变性、光感受器细胞死亡、穆勒细胞肥大和RPE根尖表面的变化都被认为是脱离引起的事件(Kroll和Machemer, 1968;埃里克森等人,1983年;Anderson et al., 1983)。最近的研究表明,在动物和人类中,光感受器细胞的死亡是通过凋亡发生的。目前还没有办法替换失去的感光器。其他事件可能通过重新附着而逆转,通常是不完全的,通常是缓慢的,时间过程从几天到几年不等。
为什么重塑很难发现
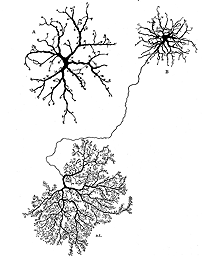
视网膜中涉及的神经元和胶质细胞数量巨大,神经元细胞结构范围广泛,神经元细胞体相对于其他细胞的尺寸较小,相互缠绕构成视网膜丛状层的神经元突起的尺寸较小,这些都使发现这些细胞的微妙变化变得困难。历史上,高尔基浸渍法提供了突破,允许详细描述单个神经元及其形态多样性(Ramon y Cajal, 1892)。一个类似的可靠的方法可以让我们观察单个神经元分支的变化,这对于研究重构是理想的。不幸的是,高尔基方法是不可靠的和不切实际的,因此不能为系统研究神经元重塑事件提供方法。毫无疑问,随着技术的发展,将会出现观察活体组织视网膜神经元结构重构的宝贵工具。
利用新技术来描述重塑事件
免疫细胞化学和其他技术允许标记单个细胞或细胞群,加上先进的图像技术,如激光扫描共聚焦显微镜,为我们提供了新的和强大的工具来描述视网膜重塑事件,近年来。杆状光感受器、杆状双极和水平细胞重塑(Lewis等人,1998年)是第一个使用该技术进行详细研究的细胞。事实上,抗体标记的结果证实了基于1983年发表的EM数据的推测:“除了外层视网膜脱离的影响外,我们强烈怀疑内核层、内丛状层、神经节细胞层,也许还有视觉系统的更多中心区域也可能受到影响,”(Erickson et al., 1983)。beplay体育公司重塑现在已经在视网膜内部牢固地建立起来,并使人们更强烈地相信中枢的变化,例如神经节细胞轴突树突和突触接触最终也会被识别出来。涉及其他成像形式的技术,包括视网膜整体或组织切片中的活细胞成像,以及向单细胞注射染料等技术,无疑将对这一快速增长的知识库做出巨大贡献。
2.水平的重构。
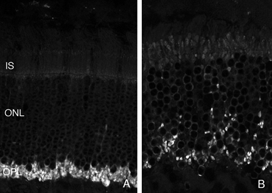
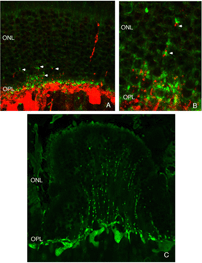
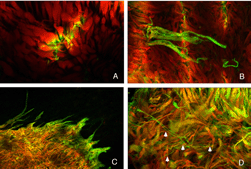
重塑可以涉及整个细胞群体,例如,所有的RPE细胞重塑其顶端突(图2A-C,星号),所有的光感受器在脱离后发生外部节段变性,或者它可以涉及群体中的一些亚群细胞。每个RPE细胞的根尖表面在脱离和再附着过程中都必须进行重塑,因为复杂的根尖突在脱离后转化为微绒毛,在再附着后再生。有趣的是,再附着后的重塑在细胞间并不一致(图2D-E)。因此,根尖表面的再生并不是发育的完美再现。所有游离区的Muller细胞都上调了中间丝蛋白,所有细胞都可能经历某种结构重塑,但只有一些细胞表现出极端的变化,它们实际上生长出视网膜,爬进视网膜下间隙或玻璃体表面。这两种情况都会导致严重的视力威胁眼部并发症。确定是什么刺激了这个亚群体经历这样的增长在医学上是很重要的。只有一个神经节细胞亚群在脱离后出现了重构(Coblentz等人,2003年),确定其中的类型可能有助于更好地理解成功的再植手术后发生的一些视觉障碍。
视网膜传入神经阻滞
中枢神经系统的传入障碍是指从某些运动通路中去除感觉输入。尽管视网膜向大脑的输出没有“运动”成分,但在一些疾病中,如色素性视网膜炎(或在这种疾病的动物模型中)发生的光感受器的大量丢失(通常接近100%)被描述为“传入障碍”。(见Marc et al., 2003)。这些系统的重塑以及白化大鼠的光损伤等情况被描述为主要是对这种“传入干扰”的反应。我们在这里关注的变化是那些发生在脱离数小时或数天内的变化,因为正是这些变化可能被治疗干预成功地操纵,从而导致更好的视力恢复。这些不是对光感受器大量死亡的反应,尽管它们可能代表了对个别光感受器死亡的反应,从而导致个别细胞或神经回路的部分失传。重构也与视网膜再植后的恢复期有关,在此期间光感受器细胞不会死亡。
了解视网膜脱离反应的基本信息
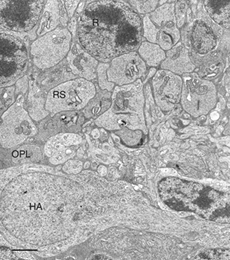
虽然视网膜是大脑发育的产物,但它确实有一些特殊功能的独特特征。光感受器是体内所有细胞中代谢率最高的细胞,但它们之间没有血管(它们的存在可能会模糊视觉图像)——它们几乎完全由位于RPE对面的脉络膜毛细血管滋养(见图1;Linsenmeier & Padnick-Silver, 2000)。传统的星形胶质细胞不像在大脑和脊髓中那样分散在视网膜中,而是只存在于神经节细胞及其轴突中。视网膜上有大量高度分化、极化的放射状胶质细胞或穆勒细胞,这些细胞可能承担大脑和脊髓中星形胶质细胞的许多功能,但同时又与它们不同。大多数物种的神经节细胞轴突直到进入视神经后才有髓鞘,因此,视网膜没有大量的少突胶质细胞,即产生髓鞘的胶质细胞。视网膜上确实有小胶质细胞(清道夫细胞)的常驻群体,但这些细胞似乎仅限于健康眼睛的内外丛状膜层。
脱离和再依恋的动物模型
选择使用哪一种视网膜是由许多问题驱动的,包括:1)视网膜结构与人类视网膜的相似程度。2)了解该物种的视网膜回路、生理学或生物化学。3)可创建受控分离和再附着的可靠性。4)研究的具体目标。
不同物种的反应不同:寻找最佳模式
不同的物种对脱离的反应不同,并不是所有这些都准确反映了我们对人类视网膜的反应所知甚少。兔视网膜(与猫视网膜的杆锥比大致相同)的大部分神经视网膜表现出非常迅速和完全的变性(Berglin et al., 1997;Faude et al., 2002),因此它不是一个较长期事件的好模型。地松鼠的视网膜以视锥细胞为主(Long & Fisher, 1983;Kryger et al., 1998),因此是人类黄斑反应性的潜在模型(除了地鼠视锥在结构上不像黄斑视锥)。然而,地鼠视网膜的光感受器层表现出快速并最终完全的退化,但几乎没有RPE或胶质反应性或神经元重塑(Linberg等人,2002a;酒井等人,2001)。与兔子不同的是,它没有表现出视网膜内变性。我们已经在各种研究中使用了所有这些,但似乎最接近模拟人类分离事件的物种是普通的家猫。许多灵长类动物的视网膜都是有中心凹的,但由于各种各样的伦理和经济原因,它们的使用往往是被禁止的。
开发新的模型系统
由于遗传信息的可获得性和易于进行遗传操作的能力,开发一种可靠的方法在小鼠眼睛中产生大型的、可控的分离已成为近年来的优先事项(例如,Nour等人,2003;Yang等人,2004)。目前该模型的数据显示,在猫模型中发现了许多相同的反应,尽管穆勒细胞的反应可能更少。脱离的高度,即分离的神经视网膜与RPE之间的距离,可能是人类脱离的一个重要参数,而高脱离在小鼠身上更难产生,因为小鼠的眼睛较小,而且晶状体占据了玻璃体腔的大部分。在更大的物种中,使用与人类相同的步骤进行的再附着可以进行,但是否可以在老鼠的眼睛中进行还有待观察。简单地让视网膜沉淀下来,而不是主动地把它重新接上,这是一种方法,但对重新接上的时间没有那么精确的控制。另一个有前途的领域是在类似的实验中使用冷血动物(如青蛙、鱼、蝾螈),因为它们的视网膜在培养中相对容易保持,而且其中许多动物具有非常大的感光细胞,适合于高分辨率成像和其他类型的单细胞分析。然而,目前的大部分工作都是在哺乳动物物种上进行的。
猫科动物模型
猫的视网膜和人的周围视网膜一样,都是杆状支配的。这是一种视网膜内循环强健的物种(和所有物种一样,它不受光感受器的影响)。猫的视网膜也是几十年来解剖学和生理学研究的主题。猫科动物的眼睛很大,便于外科手术,也可以像人类患者一样,使用相同的程序进行确定的分离和简单的再附着。
通过尖端直径约为100 μ m的锥形玻璃移液管,将液体缓慢注入RPE和神经视网膜之间的界面,形成分离(Lewis等人,1999年)。有人认为(Aaberg, 1999)这不是孔源性脱离的模型,因为视网膜组织中没有大的撕裂(称为“视网膜破裂”)。然而,我们对人类孔源性分离和再附着组织的观察倾向于证实猫模型产生相同的细胞反应(Sethi et al., 2004)。
3.脱离和再附着后细胞重塑的细节
图1显示了迄今为止已确定的细胞类型,在脱离和再附着后进行重构。我们只有关于无分泌细胞结构重构的初步证据,尽管这已被描述为晚期人类视网膜色素变性(Fariss et al., 2000)。除了知道视网膜星形胶质细胞在脱离后增殖外,对它们的变化知之甚少。视网膜小胶质细胞通过假设巨噬细胞样特征,对脱离反应强烈(Thanos等人,1996;刘易斯等人,2005年出版)。虽然它们无疑在视网膜组织的整体“损伤反应”中起着重要作用,但在此不作讨论。
视网膜色素上皮
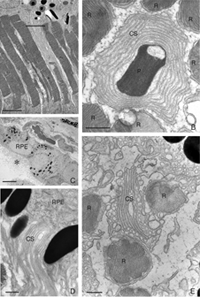
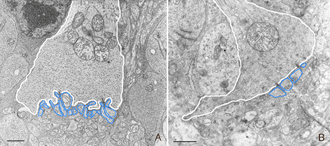
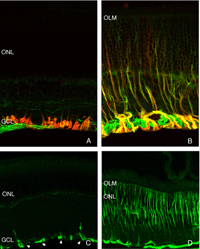
在所有被研究的物种中,RPE的形态在分离后发生了立体变化。在猫、狗、兔子和人类等物种中,与视杆细胞和视锥细胞相互作用的尖突之间存在巨大差异(Anderson & Fisher, 1979;斯坦伯格等,1977年;斯坦伯格和伍德,1974年;Fisher & Steinberg, 1982),“锥体鞘”形成了一种独特的结构,由高度复杂的、多层的根尖突片阵列组成(图2A, B)。不论它们在正常眼睛中的结构如何,这些根尖突在脱离后都消失,并很快(可能在数小时内)被一种简单的微绒毛样突起边缘所取代(Immel, Negi & Marmor, 1986;图2 c,星号)。再植后,RPE具有重新形成这些复杂尖突的显著能力。就猫科动物的视网膜而言,这也意味着再生高度复杂的锥鞘。然而,重新连接一个月后,这些锥体鞘仍然不显示“正常”。轻度截短、增厚或排列不整齐的锥体鞘的存在几乎总是一个明确的信号,表明视网膜在较早的时候已经分离(比较图2A、B、D、E中标记为“CS”的结构)。锥体鞘只与锥体外节段有关,这一事实表明,在成人视网膜中保留着某种形式的信号机制,使RPE能够知道它的顶端表面何时与锥体相对。
RPE因脱离而增殖,这可能导致该层的几何形状完全重塑。新增殖的RPE细胞可以迁移到视网膜下间隙,在那里它们具有复杂的几何排列:单细胞、长链或顶端-基底极性相反的多层(Anderson et al., 1981)。如果基底面面对神经视网膜,光感受器外段在再植后不发生再生(Anderson et al., 1986)。目前尚不清楚在RPE多层存在的情况下,外部节段的再生是否损害了感光器的功能。
光感受器解构,外节段退化和细胞死亡
在猫的模型中,可能在人类的视网膜中,脱离会使所有的光感受器,包括脱离区域内的视杆细胞和视锥细胞,沿着我们称为“解构”的结构变化路径运行(Mervin et al., 1999)。杆状神经和锥状神经的内外段反应似乎是相同的,但突触末端反应不同。在猫和人的视网膜中,很明显,许多细胞脱离后仍能存活很长一段时间。解构变化可能是保证细胞在不利环境条件下存活的一种机制,即一种节省代谢能量的手段。目前还不清楚为什么在某些物种(地松鼠、兔子)中,分离会导致几乎所有光感受器的解构和细胞死亡,而在其他物种中,大多数光感受器能够存活很长一段时间。
脱离后,外节段材料丢失,直到只剩下少量的椎间盘和连接纤毛(Anderson et al., 1983)。椎间盘形态发生的复杂机制不会在这些细胞中丢失(Steinberg, Fisher & Anderson, 1980),因为一旦重新连接,它们保留了重建外节段的能力,即使这种重建可能并不完美。其余的杆状光感受器外节段,即使只由少数椎间盘组成(图3A-C),其视蛋白仍呈阳性(图3;图4;刘易斯等人,1991年;Fariss et al., 1997)以及其他蛋白质。
死亡的细胞凋亡
大多数感光细胞脱离后的死亡是由细胞凋亡(程序性细胞死亡)引起的。根据我们对猫视网膜的研究结果,有一个早期时期,在脱离后的头3天左右,大约20%的光感受器死于凋亡(Cook et al., 1995;Lewis et al., 2002),但分离450天的视网膜可以保留至少50%的感光器(Erickson et al., 1983)。对人类分离的观察也表明,细胞凋亡是它们对分离反应的一部分,但与猫科动物模型一样,大部分光感受器种群也存活了下来(Chang et al., 1995)。没有关于分离后中央凹感光器的生存能力的信息。在猫模型中很少观察到视网膜内细胞因脱离而死亡,尽管零星的细胞死亡可能很重要,但也很难记录。
光感受器内节的内部重组
分离后,电子显微镜和对线粒体成分的免疫细胞化学标记显示,内段线粒体数量减少,所有细胞器的分隔性也明显减弱(Anderson et al., 1983;埃里克森等人,1983年;Mervin et al., 1999)。维持光感受器的高度分隔和极化结构必须消耗大量的代谢。让细胞采用更简单的组织结构可以确保它们在具有挑战性的环境条件下存活。在脱离的情况下,这种挑战包括缺氧和低血糖,这是由物理移动视网膜远离脉络膜血液供应造成的(Mervin et al., 1999;刘易斯等人,1999;Linsenmeier & Padnick-Silver, 2000)。这一假设得到了一些研究的支持,这些研究表明,提供更多的环境氧气可以减少光感受器的解构和分离后的细胞死亡(Mervin et al., 1999;酒井等,2001; Lewis et al., 2004).
杆和锥的响应比较
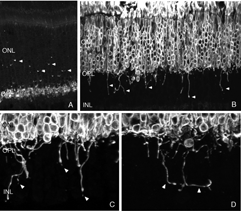
杆状细胞和视锥细胞的内外段经历了类似的结构变化,但杆状细胞的一个突出反应是轴突的退出(图5A,B)和单一突触内折的3-5突触后突起的重新配置(Boycott & Kolb, 1973;科尔布,1974)。这种反应在视锥细胞中没有观察到。
图5。正常视网膜标记有突触前蛋白,突触素的抗体。标记是特殊的层光感受器突触终端在OPL。B.视网膜脱落3天。紧凑的OPL被破坏,RS缩回到ONL
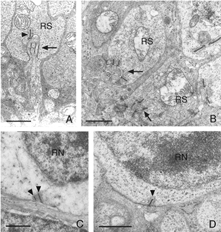
这种破坏可以通过免疫细胞化学标记的突触前囊泡蛋白,如synaptophysin(图5)或VAMP (synaptobrevin)。脱离后,标记终端出现在弥散在外核层的棒核附近(图5B)。终端退出和重组在一天内开始。图6中的电子显微镜图显示了正常猫科动物视网膜外丛状层的杆状终端高度紧凑的组织。分离后,每个突触的深层内陷变得更浅(箭头,图7A, B),并最终完全消失(图7C, D)。在缩回的末梢基部附近仍有与“突触后”突相关的膜特化(图7C, D)。那些不缩回的末梢也可能随着突触后过程的“松散”组织而发生变化(图7B)。
提取的杆状终末显示稀疏的突触囊泡和突触带,它们在大小、结构和位置上的差异比预期的要大。而在正常的猫棒状球体中有一到两条长长的、弧形的突触带(Boycott & Kolb, 1973;Migdale et al., 2003),在缩回的终端中,1-3条缩短的缎带是常见的(图7A, C, D箭头)。
锥体蒂不从OPL中撤出。然而,椎弓根本身的形状会发生不可预测的变化。有些细胞的轴突变得弯曲,而不是从细胞体直接穿过外核层(图8A-C)。然而,在所有情况下,这些末梢似乎都失去了9-14突触内陷(Boycott & Kolb, 1973)(图9A, B),使其基底呈扁平状(图8C)(也见Erickson et al., 1983)。突触前带在杆和锥体中都发生变化
突触前带似乎变短,有些可能消失(图9A,B)。当使用特异性抗体进行免疫细胞化学标记时,这种带状反应是显著的(Schmitz et al., 2000)。杆状末端的突触带呈“簇状”(对比图10B和图C中的红色突触带与图10D中的红色突触带)。在锥体椎弓根内,在外丛状层(图10D)不再检测到特征条带阵列(箭头,图10C)。在电子显微镜下,受影响的锥体末端内仍保留非常短的带,一些突触后突起仍可识别(图9)。
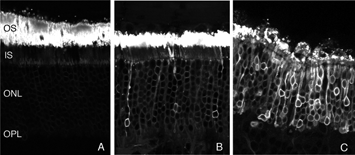
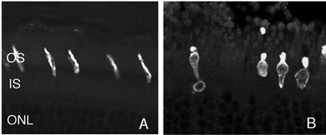
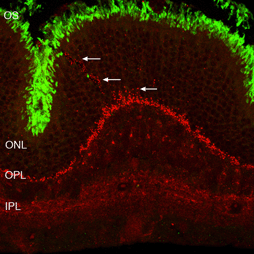
在此之后,杆状末端的重塑变得相对简单,因为它们由移位的视紫红质勾勒而成。记录锥体突触的长期变化是复杂的,因为锥体中的蛋白质表达迅速下降到低于检测水平(Rex et al., 2002a;Linberg等人,2001a)使它们难以通过免疫细胞化学可视化。(图8 A, B, C,D)。在图11中,视网膜有很长的扩张,其中只有杆状外节段(绿色)被抗pdeg_标记,没有标记的视锥细胞。
球果的种群是异质的
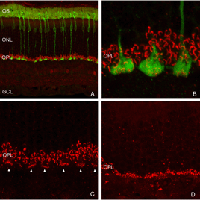
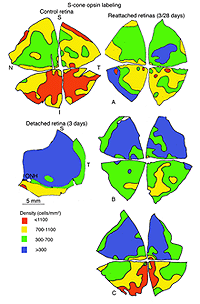
凝集素,花生凝集素(PNA),标记锥体光感受器周围的细胞外基质域(基质鞘)(Johnson et al., 1986),可用于定义锥体细胞的总数。图12A是对照(正常)猫视网膜颞上象限PNA标记锥鞘的密度图(也见Steinberg等人,1973)。
有一种特异性抗体可以识别不同光谱级别的锥光感受器(Wang et al., 1992;Szel等人,1985;1988)。猫视网膜包含中波长敏感(M)和短波敏感(S)视锥,后者在视网膜地形上分布不均匀(图13A)。视锥细胞的总数在中央区达到峰值,s视锥细胞的密度在下视网膜最高,但即使在那里,它们也只占视锥细胞总数的20%左右(Linberg等,2001a)。
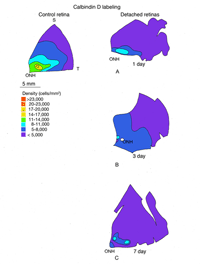
视蛋白基因的表达可靠地定义了光感受器的不同亚群。这些细胞对其他蛋白质的表达就不那么一致了。钙结合蛋白calbindin D的抗体标记了许多物种的整个锥细胞,包括人类和猫科动物。calbindin D阳性细胞的密度与周围视网膜中PNA标记的锥基质鞘的密度非常接近,但在中心区域有显著的差异,在那里抗体不能标记大多数锥细胞(图14A)。这种现象也发生在猴子和人类的视网膜上,它们的视网膜中心凹锥细胞没有标记抗钙结合蛋白D (Rohrenbeck等人,1989;巴特尔斯等人,1990;Haley等人,1995)。
4.脱离后锥体光感受器的蛋白表达:幸存锥体光感受器阵列的分析
下面是相当详细的圆锥种群在脱离和再附着后的变化描述,如图12和13所示。对于那些想略过细节的人:视网膜脱离后视锥细胞似乎消失了,因为它们1)失去了外部节段,2)失去了特定蛋白质的表达。将视锥蛋白的回归作为视锥恢复的指标表明,在视锥再植后28天,视锥镶嵌与正常视网膜不一样。两种球果都能恢复,尽管s型球果的恢复可能不如M型球果完全。视网膜锥体镶嵌体因脱离而受到干扰,其恢复不一致可能导致再植后的视力缺陷,特别是当视网膜中央凹受累时。关于中央凹内锥体镶嵌的恢复情况,我们一无所知。
随着杆状细胞外段退化,杆状视蛋白标记开始在细胞的质膜中增加,直到勾画出整个细胞(见图3;刘易斯等人,1991年;法里斯等人,1997年;Rex et al. 2002a;Linberg等人,2002a)。因此,杆状视蛋白抗体可作为杆状细胞存在的标记(标记的重新分配也是杆状细胞受到应激或损伤的显著指标)。尽管锥视蛋白抗体开始显示类似的重新分布,但仅在分离24小时后,许多锥视蛋白就无法用这些抗体进行标记(见Rex等人,2002a)。类似的现象也发生在晚期基因变性的人类视网膜中(John et al., 2000)。
因此,正常视网膜中视锥细胞的标记对于估计脱离后存活的视锥细胞数量并不可靠(Linberg等,2001a)。事实上,如果脱离后缺少标记的圆锥是圆锥存活的准确反映,那么脱离对圆锥种群的影响将是毁灭性的(Linberg et al. 2001a)。对视锥细胞使用标记的进一步混淆的事实是,标记与标记之间的反应并不一致,甚至在视网膜的一个区域与另一个区域之间也不一致。
在对照视网膜的中心区域,抗钙结合蛋白D标记约19,700个感光细胞/mm2,抗s锥视蛋白抗体标记约1,100个/mm2。脱离24小时后,这些数字分别下降到9000 /mm2(控制值的46%)和700/mm2(控制值的63%)。分离28天后,没有细胞被标记为抗钙结合蛋白D,但200/mm2(18%的对照值)被标记为抗s视蛋白(Linberg等人,2001a,见图13B, 14B-D)。在脱离的视网膜中,有大片区域完全没有锥体标记(见图10和图11中PDEg的例子),好像该区域的所有锥体都消失了。这些显著的变化反映在s -视蛋白和抗钙结合蛋白D标记的密度图上(图13、14)。在后者中,分离1天后中心区域几乎无法识别,3天后完全没有定义。同样,对照组视网膜s锥的数量在脱离3天后从700-1100/mm2下降到不到300。由于制作这些地图所用的箱子相对较大,它们没有显示出没有标记锥体的实质岛屿。标记视锥细胞数量的广泛变化使视网膜整体呈“斑块状”,这在对照组视网膜中是观察不到的,在对照组中视锥细胞密度的过渡是平滑渐变的。
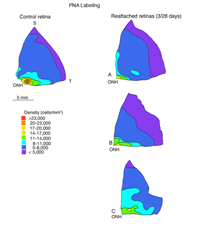
我们以另一种方式探讨了锥体存活的问题:通过检查再附着后锥体标记的恢复(Linberg等,2002b)。我们选择分离3天,因为在那个时候,花生凝集素(PNA)、抗球果视蛋白或抗钙结合蛋白D标记的球果种群已经显著下降。3只动物右眼上视网膜分离3天,再植28天。采集视网膜并用PNA标记(图12,PNA =所有视锥,仅示颞上象限)和s视蛋白抗体(图13)。可以与总球果图进行比较(钙结合蛋白D标记,对照和3天,图14A, C;PNA标记,对照视网膜,图12A)和s锥(s锥视蛋白标记,对照和3天,图13a, B)。再植后PNA和s锥种群均恢复;事实上,在PNA标记模式中,中心到周边的梯度是明显的,尽管密度仍然较低。没有一种动物恢复的密度大于17,000-20,000球果/ mm2(图12B-D)。类似地,s锥种群数量恢复,但恢复不完全(图13C-E)。颞上象限远缘s锥的高密度区域在再植28天后没有恢复,在所有三种动物中,中央视网膜的恢复范围为300-700个细胞/mm2,而对照视网膜观察到的恢复为700-1100个细胞/mm2(脱离没有延伸到图13E中心区域的黄色/红色区域)。
由于这些数字是由小采样区域和人眼绘制的等高线产生的,因此很难选择再附着视网膜内锥密度的平均值,但使用在相当广泛的区域内采样的锥密度估计,对两个再附着动物的结果显示,在中心区域PNA标记的恢复率为40-60%,而在周围区域的恢复率接近100%。
s锥恢复似乎更加多变,范围在0到40%之间,在视网膜上没有容易识别的模式。PNA标记的锥基质鞘在视网膜上显著均匀分布,并显示中心向外周的衰退,而s视蛋白标记显示在再附着的视网膜图中有大量的色板,但没有可见标记。这些数据定量地表明,脱离的视网膜中标记分子的缺失并不表明锥体光感受器的缺失,因为细胞在整个视网膜上都恢复了,在某些情况下,其数量与对照组的眼睛相当。当然,还不知道在较长的再附着时间内,这些蛋白质是否会有更多的恢复。
在结构上,再植28天的视网膜s锥外节段与正常眼不相同。它们通常只是点状的“点”,是它们正常大小的一小部分。据报道,s锥群体对脱离的视网膜损伤更加敏感(Nork et al., 1995),在脱离几天内,所有s锥要么丢失,要么显示出“不可逆损伤”的迹象。我们从猫视网膜获得的数据可能支持S视锥细胞比m视锥细胞更脆弱、更容易死亡、恢复更慢的概念,但是,它并不支持所有S视锥细胞都是不可逆损伤的结论。
结合电生理(ERG)和免疫细胞化学研究,对以球果为主的地鼠视网膜进行的研究显示,该物种对S-和M/ l -球果信号的恢复没有任何特殊差异(Jacobs等,2003年)。
从这项研究和其他研究中得出的最显著的结论可能是,当细胞处于某种生理压力下时,视锥细胞似乎停止表达特定的蛋白质,然后,至少在再附着的情况下,开始重新表达这些蛋白质,作为恢复过程的一部分。Nork et al.(1995)在对人视网膜组织的研究中报道,碳酸酐酶反应性在剥离后成为m -锥体的不可靠标记,表明其可能加入严重下调蛋白的行列,其丢失可能不是不可逆损伤的指标。
中央凹锥细胞是否表现出类似的反应是一个没有答案的问题。灵长类动物视网膜的外周视锥与中心凹视锥在结构上不同(Anderson et al., 1978;Anderson & Fisher, 1979)所以他们对受伤的反应和恢复能力也可能不同。
M/L-和s -锥细胞的差异缺失,或这些细胞在人类中的差异恢复,可能解释了再附着患者报告的一些色觉缺陷,并可能是涉及到中央凹时视力下降的基础。
5.光感受器再附着后的重建
自1968年以来,人们就认识到光感受器外节段在再附着后会重新生长(Machemer, 1968;Kroll and Machemer, 1969a,b)。这种显著的能力可以通过光感受器不断添加新的外节材料作为外节更新过程的一部分这一事实进行机械解释(Young, 1967)。因此,只要条件允许,它们随时准备重建外部部分。
事实上,对脱离视网膜的研究表明,在脱离后退化的视杆细胞的截短的外节段中,放射标记的蛋白质继续被运输(Lewis et al., 1991),尽管对视杆细胞视蛋白、外周素/rds (Fariss, et al. 1997)和ROM-1 (Lewis, G.P. & Fisher, S. K.,未发表的观察)分布的研究表明,当视杆细胞的外节段退化时,蛋白质的靶向和运输发生了改变。
从实验数据中有一些证据表明,质膜中视蛋白的存在可能使光感受器更容易发生凋亡细胞死亡(Zhang & Townes-Anderson, 2002)。
恢复的视杆细胞在结构上看起来更像正常视网膜中的视锥细胞,而视锥细胞的形状往往是扭曲的。通过电子显微镜观察,恢复的灵长类视锥细胞也显示出改变的外节结构(Guerin等人,1989年)。现在已经认识到,再附着患者的视力可能会在数年内继续恢复(Liem et al., 1994;Ross, 2002),这可能反映了中央凹锥体外节段的缓慢恢复。锥体视觉的恢复可能因锥体复杂的光学性质和它们相对于瞳孔的排列而进一步复杂化(见Rodieck 1998年的讨论;斯泰尔斯-克劳福德效应,斯泰尔斯和克劳福德,1933年;Enoch, 1963和Rodieck, 1998),以及它们与根尖RPE的结构特殊化界面。
光感受器突触末梢的恢复
另一极的杆状细胞也必须恢复。由于复接一个月后,外丛状层的外边界又由一层相对致密的杆状突触终端组成,因此被拔出的杆状终端会有一定程度的恢复。这与分离视网膜中出现的高度破坏层形成对比(对比图5B和15A)。目前还没有对这些再生突触进行详细的结构、分子或生理分析。
有些杆状轴突生长过度
由于一些视杆在重新附着后继续在质膜中表达视蛋白,我们能够识别出远远超出外丛状膜层并延伸到视网膜内部的视杆轴突,并在INL和IPL的不同水平终止(箭头,图15B-D)。这些“过度生长”的轴突的末端也标记有与突触囊泡、突触素和VAMP(图中未显示)相关的蛋白质的抗体,但它们不表达带特异性蛋白——眼。
在早期视网膜发育过程中,一组视杆细胞也“超过”了它们的突触靶层,这与我们在再附着的视网膜(Johnson等人,1999)、在患有晚期遗传性视网膜退化的人类视网膜(Fariss等人,2000)和有复杂分离和再附着史的视网膜(Sethi等人,2004)中观察到的图像基本相同。令人好奇的是,它们似乎并不发生在脱落的猫视网膜上,而是在重新附着后才出现。异位末端有纤细的丝状足状延伸(图15C,D,箭头)。过度生长的轴突是否会留在原地,或最终被收回,甚至承载它们的细胞最终死亡,对于发育和再附着来说都是未知的。
复接后圆锥端子的重塑
到目前为止,关于再附着后锥体末端异常复杂的突触的“再分化”或重塑的数据很少。视网膜脱落3天,再附着28天,圆锥蒂伴突触内陷再次出现。总的来说,光感受器突触的再分化,以及再附着后特定突触前后分子的表达图谱,是一个未被探索的领域,但似乎是充分理解与视觉恢复相关的事件的关键。
6.重塑二级和三级神经元
杆双极细胞
棒状双极细胞支配棒状球体。每个棒状球通常是两个不同的棒状双极细胞的突触前,每个棒状双极细胞接触16到20个棒状球(Freed et al., 1987)。棒状双极树突深入到棒状球的内陷处,在两个(平均)突触带的对面终止(图6,7a;抵制&科尔布,1973年)。
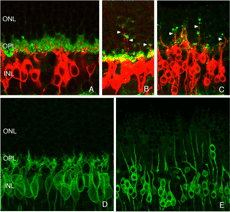
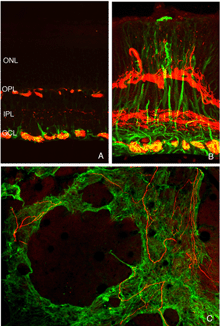
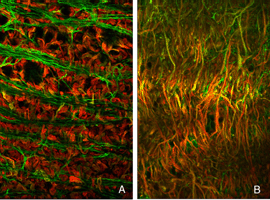
杆状双极细胞和杆状小球之间的一般关系可以通过抗体共聚焦成像观察到(Negishi et al., 1988;Wassle et al., 1991)来标记每种细胞类型(图16A,绿色=抗突触素,突触末梢,红色=抗pkc,杆状双极细胞)。在正常的猫科动物视网膜中,棒状小球粒的致密层非常突出(图5A,图16A,绿色)。棒状双极枝晶不向外核层延伸。
当杆端退出时,杆双极枝晶重新形成
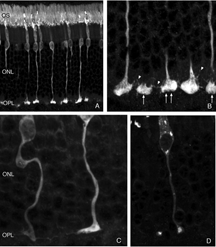
当杆状末端在剥离后被破坏时,会出现细的、锥形的树突,从杆状双极细胞延伸到外核层,通常终止于脱落的杆状突触末端(箭头,图16B)。这种重塑的树突分支在脱离后的3天内很明显,它们的数量随着脱离时间的增加而增加。
这些细胞上可能也有树突的“修剪”。在对照组视网膜中,树突呈细小的“丝状”突起,从细胞体延伸到外丛状层(OPL,图16D)。在离体视网膜中,这些不那么明显,导致一些树突退缩,而另一些树突变长(图16E)。树突修剪似乎是其他形式视网膜变性双极细胞的主要反应(Marc et al., 2003),但在这些情况下,反应出现在疾病的晚期。
水平细胞
猫视网膜有两个形态学上截然不同的水平细胞(图17);一种有粗壮的锥形树突,没有轴突(a型);另一种有稍细的高度分枝的树突和细长的轴突,形成精致的轴突末端(b型;道林等人,1966年;Fisher & Boycott, 1974)。电子显微镜显示,A型和b型细胞的树突支配锥体末端,而只有轴突末端的分支支配杆状球体(Kolb, 1974)。薄的B细胞轴突不与细胞体进行电通信(Nelson et al., 1975)。
抗体标记特征定义水平细胞亚型
a型细胞中神经丝丰富,b型细胞中神经丝稀少,但并非完全缺失。这反映在对神经丝蛋白复合体的70和200 Kd亚基的抗体对a型细胞的大量标记上。钙结合蛋白钙结合蛋白D和钙维甲酸的抗体也标记水平细胞。利用这3种抗体,我们可以区分猫视网膜中的2个亚型。
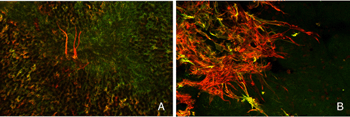
我们最初观察到剥离后外核层相当厚的珠状钙结合蛋白d阳性突起(图18A左侧红色突起,图18C绿色突起)。这些生长出的细胞带有抗神经丝蛋白的抗体。事实上,分离后该抗体水平细胞标记强度大幅增加(红色,OPL,图19A, B),很可能表明重构细胞中蛋白表达上调(Linberg等,2004年)。
点击此处观看分离视网膜中水平细胞神经突(红色)从周围的穆勒细胞突起(绿色)中生长出来的电影。1 MB的Quicktime电影。
使用这三种抗体中的任何一种,我们实际上可以检测到两种水平的细胞生长;那些终止于收缩球粒附近的球粒(箭头,图18A, B),即“有向球粒”,以及那些不终止于收缩球粒附近的球粒,即“无向球粒”(图18A, 19B, 20D, 20E)。这种惊人的“无定向”生长是为水平细胞提供某种功能或生存作用,还是仅仅是损伤反应的痕迹,目前尚不清楚。令人惊讶的是,在3天或更长时间的分离中,这些赘生物通常会延伸到外限制膜和视网膜下间隙。这通常与穆勒细胞突起(绿色,图19B, C)一起发生。一旦在视网膜下间隙,水平的细胞生长(红色,图19D)从不会在暴露的感光细胞本身上生长,而是总是嵌入在穆勒细胞突起的网状结构中(绿色,图19D),在那里它们可以跑很远的距离。
水平细胞在上行和下行神经炎中均有延伸
一些水平细胞生长是相当厚的过程,从水平细胞下降到视网膜内部,尽管观察到的规律性远不如上升到外层核层的规律性。Marc等人(1998;2003年)在脱离的猫视网膜和其他形式的视网膜退化。事实上,在光感受器极度丧失的情况下,它们似乎是最常见的水平细胞重塑形式(Marc et al., 2003)。截面材料和整体材料的“无向”上升过程以两种结构形式出现;一种是由薄的,通常带有串珠的圆柱形突起组成,另一种是扁平的带状突起。这既可以单独发生,也可以成群发生(图18C)。在视网膜下间隙内,长时间延伸的突均呈薄的圆柱形,常呈珠状(图19D)。但是,当那里发生较厚的肉质突起时,它们通常会大量分支,产生复杂的组合,使人联想到外层丛状层中b型细胞轴突末端的稀疏版本(图20F)。
水平细胞的起源生长
通过结合神经丝蛋白、钙结合蛋白D和钙维黄素的抗体进行标记,并将输出颜色分别指定为绿色、蓝色和红色,我们确定特征形状的a型细胞颜色为蓝色/白色(即全部3种抗体都高度标记;图20A,B,C中的HA),而适合B型的形状和位置的细胞呈红色或接近红色(由于几乎缺乏抗神经丝抗体的标记;图20B,C中的HB)。进入ONL的突起,包括到达视网膜下间隙的长突起,都具有b型细胞的免疫化学标记“特征”(图20D, E;20 f)。当在视网膜下间隙通过外核层追踪到分支突时,发现其起源于具有轴突末端组织特征和b型细胞免疫化学特征的复杂神经丛(箭头,图20D, E)。因此,证据表明这些突起起源于b型水平细胞的轴突末端。
是什么驱动了杆状双极和水平细胞神经突的生长?
虽然生长是对神经棒释放(或缺乏)某些因素的反应是一种可能,但从培养神经元的研究中,机械张力可以诱导神经突生长的另一种机制被提出(Lamoureux et al., 2002)。如果杆状双极细胞树突和水平细胞轴突末端机械地连接到回缩杆球,由回缩杆球产生的张力可能会启动突触后神经元的生长反应。有向生长和无向生长的产生机制是否相同还没有答案。
7.神经节细胞重塑
神经节细胞的一个子集对脱离的反应强烈地重塑。神经节细胞是离脱离部位最远的视网膜神经元。然而,重要的是要记住神经节细胞被穆勒细胞突起包围,而穆勒细胞的顶端直接接触到实际的损伤部位(视网膜下间隙)。Muller细胞对分离的反应也非常快(Geller et al., 2001),因此很容易驱动神经节细胞的反应。此外,神经节细胞的反应性可能依赖于源于杆状和锥状突触变化的跨神经元变化。
GAP 43表达、神经丝蛋白表达及神经节细胞重塑
生长相关蛋白(GAP 43)的表达通常与轴突生长锥和突触发生有关(Skene, 1989;中国科学院学报(自然科学版),1998,11;Strittmatter et al., 1992),一般在与突触发生相关的发育期后显著下调(Benowitz et al., 1988;弧拱,1989;Gispen等,1991;Meberg和Routtenberg, 1991;中国科学院学报(自然科学版),1998,11;Kruger等,1993;Kapfhammer等人,1994年;Benowitz和Perrone-Bizzozero, 1991b)。 Mice in which GAP 43 has been genetically removed show a tangling of axons in the optic nerve (Strittmatter et al., 1995) while mice over-expressing GAP 43 show an enhanced sprouting of axon terminals in both central and peripheral neurons (Aigner et al., 1995).
当神经节细胞迁移到其特定层并开始轴突生长过程时,视网膜中出现GAP 43的表达。它在成人中仅作为层状标记存在于内丛状层中(De la Monte et al., 1989;贝诺维茨& Perrone-Bizzozero, 1991b;Reh等人,1993年;Kapfhammer等,1994;McIntosh和Blazynski, 1991)。这是在成年猫科动物视网膜上观察到的模式(Coblentz et al., 2003)。免疫印迹分析也显示在正常成年猫视网膜中有一些GAP 43蛋白表达(Coblentz et al., 2003)。
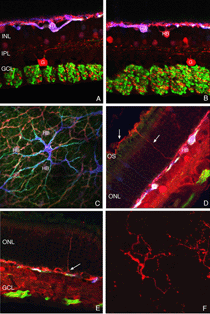
免疫印迹、免疫细胞化学和实时PCR数据均显示,在视网膜脱离后的第一天,GAP 43的表达开始上升,并在最后一个实验时间点28天继续增加。免疫组化数据显示,脱离后7天的动物有大量神经节细胞体标记(红色突起,图21A;Coblentz et al., 2003)。GAP 43阳性的神经节细胞与抗神经丝蛋白抗体的标记也显著增加。在正常视网膜中,该抗体仅标记内丛状层和神经节细胞轴突中的少数突起(红色,IPL和GCL标记,图19A;。科布伦茨,et al ., 2003)。分离后,它在IPL和神经节细胞层的细胞体上大量标记(红色,IPL, GCL标记图19B,图21B, C)。这种标记与增加的抗神经丝标记共存。
脱离后的神经节细胞形态
脱离后,GAP 43/神经丝阳性神经节细胞表现出不同寻常的形态,不像文献中报道的猫科动物(或其他哺乳动物视网膜)神经节细胞,有大量小的尖状突起从其细胞体向神经纤维层延伸(图21C;Coblentz et al., 2003)。随着脱离时间的增加,GAP 43/神经丝阳性神经突从标记的神经节细胞延伸,并完全穿过神经视网膜进入视网膜下间隙(图21B, C,箭头)。这些过程通常口径一致,没有明显的分支。
神经节细胞的重塑是“极端的”
因此,重构后的神经节细胞的图像与重构后的水平细胞轴突终末非常相似,因为两者都产生大量的“无定向”突起,这些突起可以在视网膜上生长很长一段距离,并进入视网膜下空间。来自神经节细胞的神经突也倾向于出现在视网膜内或视网膜下间隙的反应性穆勒细胞的突起附近。有趣的是,通过手术从人眼中取出的视网膜下膜中已经发现了神经元过程(Lewis & Fisher,未发表的观察结果)。
哪种神经节细胞类型可以改造?
从视网膜整体的尺寸测量用于产生GAP 43标记神经节细胞的染色体区域的频率分布。数据显示在600 μ m2处有一个较大的峰值,但也有一小群细胞聚集在3000 μ m2附近(Coblentz et al., 2003),这表明它是α神经节细胞类型(Kolb et al., 1981;Boycott & Wassle, 1974)的改造。
再植后神经节细胞重塑。
视网膜再植可诱导神经节细胞神经突进入玻璃体,并与Muller细胞产生的视网膜前膜结合(箭头,图21C,箭头图21D)。因此,玻璃体中的反应与视网膜下间隙中的反应相似;神经突的生长与反应性穆勒细胞过程相关,但玻璃体的生长只有在再植后才开始,可能是因为再植也启动了穆勒细胞进入玻璃体腔的生长(Lewis et al., 2003)。来自人玻璃体膜病理标本的数据也显示抗神经丝标记过程的存在(Sethi et al., 2004)。
8.神经胶质细胞重构
Muller细胞
穆勒细胞脱离后广泛肥大。他们还显示了核迁移,细胞分裂和生长到视网膜下空间。通过简单的组织学观察,所有这些都是显而易见的(Machemer, 1968;埃里克森等人,1983年;安德森等人,1983;Anderson et al., 1986)。
中间丝细胞骨架及重构
这些细胞的结构肥厚与中间丝蛋白、胶质纤维酸性蛋白(GFAP)和波形蛋白的表达增加有关(Lewis et al., 1989;Lewis等人,1995)。电镜也显示这些活性细胞的细胞质中中间丝的数量大量增加(图22;埃里克森等人,1987)。
图22。视网膜脱离后,视网膜外穆勒细胞的细胞质中有直径10纳米的细丝。这些中间丝状物标记有GFAP和波形蛋白的抗体。在正常视网膜中,它们主要局限于这些细胞的足端区域。比例尺= 0.5 μ m
大脑和脊髓中的星形胶质细胞反应相似,尤其是GFAP上调时(Kerns & Hinsman, 1973;英和迪尔蒙德,1981年;1989)。
穆勒细胞的反应是明显和剧烈的
Muller细胞GFAP反应如此显著的原因是,这些丝状蛋白几乎只定位于正常视网膜的足端区域(红/黄标记,图23A),并且在一些物种中,如大鼠和小鼠,目前的免疫细胞化学技术几乎无法检测到(图23C, Bignami和Dahl, 1979;艾森菲尔德等人,1984;Sarthy和Ripps, 2001)。损伤时,这些细胞的细胞骨架重塑与形态变化密切相关。事实上,相关性是如此紧密,以至于它们通常被认为是功能相关的事件。支持这一论点的事实是,在地鼠视网膜中的穆勒细胞不会因脱离而肥大,其中间丝细胞骨架保持不变(Linberg等,2002a)。脑损伤后,vim-/-/GFAP-/-小鼠星形细胞瘢痕形成受损,但仅缺乏两个中间丝基因中的一个的小鼠没有损伤(Pekny et al., 1999)。同样的原理是否适用于穆勒细胞还有待确定。
穆勒细胞端足是中间灯丝反应的起源
脱离一天后,足端中间丝蛋白在数量上变得更加密集,通常形成螺旋状或波状束(红色/黄色标记,图23B;埃里克森等人,1987)。它们似乎从远端肿块生长,延伸到足端分支,随着脱离时间的增加,分支的大小和数量都在增加,并顶端向细胞体生长,然后进入外视网膜(图23;24, Lewis等,1995;2003)。
脱离后Muller细胞的视网膜下生长
随着中间丝扩展到激活的穆勒细胞的顶端细胞质中,其中一些细胞开始生长,扩展到视网膜下间隙,在那里它们可以细化成多层临床“膜”(图25A,B)。
GFAP和vimentin:它们在Muller细胞视网膜下间隙的反应细节
GFAP和vimentin可以共聚形成中间丝,但我们在双标记研究中观察到两者在猫穆勒细胞中的表达存在差异。在正常视网膜中,波形蛋白占优势。与GFAP相比,这种抗体的末端足标记最重,并且标记延伸到神经视网膜更深处。在反应细胞的主干中,GFAP似乎占主导地位。当顶端微绒毛开始生长到视网膜下间隙时,波形蛋白标记占主导(图25A,红色渐尖叉状突起)。当突起扩展到视网膜下间隙时,这种表达的不平衡继续存在(图25B;Lewis & Fisher, 2003)。生长过程的“前沿”始终表现为抗波形蛋白标记的优势,GFAP的表达在神经视网膜的出口逐渐增强。这些过程或“膜”基本上在视网膜下间隙形成胶质疤痕。它们的存在似乎并不能阻止视网膜的物理再附着,但它确实抑制了外节段的再生(Anderson et al., 1986)。
点击此处观看分离视网膜中穆勒细胞过程(绿色)生长到视网膜下间隙的电影。1 MB的Quicktime电影。
再附着刺激穆勒细胞生长
玻璃的空间
在猫视网膜的复贴反应中发生了一种新的足端反应。在这种情况下,与视网膜玻璃体表面紧密粘附的支状足端突开始向玻璃体腔生长。正是这些足尾的“小枝”扩展到玻璃体形成视网膜前膜。最初的生长产物表现为细小扁平的细胞质“丝带”,从神经视网膜延伸至玻璃体腔(图26A, B)。
点击此处观看穆勒细胞末端足(绿色)在脱离视网膜的玻璃体中生长的电影。1 MB的Quicktime电影。
这些精致的扁平突与扩展到视网膜下空间的细小的锥形分枝突有着非常不同的形态。在这些足端生长物中,GFAP的表达高于波形蛋白的表达(图26A,B)。虽然vimentin的表达在视网膜下间隙扩大的Muller细胞突起中“领头”,但在生长到玻璃体的足端突起中占据这一位置的是GFAP(图26C,D)。这些细胞过程进入玻璃体会对视力产生重大影响,因为它们会收缩(Ryan, 1985),并导致神经视网膜起皱,最终再次脱离;如果涉及到中央凹,这是严重的视力威胁事件。
星形胶质细胞
人们对视网膜中这些细胞的反应能力知之甚少。它们的增殖是对脱离的反应(Fisher et al., 1991;Geller et al., 1995)和对视网膜整体视神经纤维层的观察表明,随着Muller细胞的尾足在视网膜表面扩张,其规则排列和星状形状消失(Lewis & Fisher, 2003)。
9.视网膜脱离和再植后的重塑:概述
对分离(和再附着)视网膜的研究表明,哺乳动物的视网膜具有显著的重构能力。图27显示了这里描述的神经视网膜重塑的概要。
ROS (R)和COS (C)大大缩短并从着色上皮(RPE)的顶端表面分离。许多RS从OPL中撤出。再植后,一些杆状轴突生长到视网膜内部(左边的细胞)。CP仍然存在,尽管它们经历了显著的结构重塑。RB细胞的树突生长到ONL,在退变的RS附近终止。HB的轴突末端广泛重塑,一些突起终止于退变的RS附近,而另一些则疯狂生长到视网膜外,并进入反应性Muller细胞附近的视网膜下间隙。HB轴突终末也可以生长到视网膜内部,尽管这种反应出现的频率较低。神经节细胞的一个亚群(G)从它们的基部延伸出短的、尖状的神经突,也可以生长到视网膜外层,在那里它们的行为很像水平细胞的神经突。在再植的视网膜中,神经节细胞突起也可以生长成由穆勒细胞生长到玻璃体形成的视网膜前膜。Muller细胞(M)对脱离反应强烈,在视网膜下间隙生长,在暴露的光感受器OS上形成膜或胶质疤痕。脱离后,它们的尾足会扩张,但仍留在光魔内。 After reattachment their specialized endfeet can grow into the vitreous to form epiretinal membranes as part of the disease, proliferative vitreoretinopathy. Astrocytes (A) proliferate and often appear in epiretinal membranes but their responses to detachment have not been characterized in detail.
穆勒细胞的变化可能是光感受器细胞解构和/或细胞死亡的反应,也可能是独立发生的。虽然二级神经元的重构变化可能是由光感受器的变化发出的信号,而三级神经元的重构则是由双极细胞的变化发出的信号,这似乎是合乎逻辑的,但这还没有得到实验的证实。
10.未来的挑战
脱离模型和其他各种研究的数据现在表明,成年哺乳动物的视网膜神经元仍然能够进行显著的结构重构。这反过来又为各种致盲疾病的治疗提供了更乐观的前景,在这些致盲疾病中,光感受器变性是视力丧失的主要原因。虽然防止光感受器细胞死亡是治疗这些疾病的最佳方法,但替代这一艰巨挑战的方法包括取代光感受器的技术,无论是通过细胞移植(Aramant & Seiler, 2004)还是使用祖细胞(Fischer & Reh, 2001;2003;Tropepe等人,2003)。然而,如果二阶神经元不能保持足够的可塑性来与新的光感受器形成功能连接,这种成功将是空洞的。目前看来,这种连接将形成功能性视觉的电路似乎遥不可及。然而,我们观察到的重塑程度可能是一个指标,表明视网膜内部的重塑能力比之前想象的更强。对中心凹再植患者的研究表明,视力恢复可能需要数年时间,而不是几周时间,这可能代表了适当功能的视网膜回路的重新形成,甚至是RPE/光感受器界面的重构,以正确排列中心凹锥。在脱离的情况下,防止光感受器和穆勒细胞反应也可能是治疗损伤和防止通过疾病(如视网膜下纤维化和增生性玻璃体视网膜病变)威胁视力的关键。 Adjuncts to therapy do not seem so distant in these cases, since treatment with something as simple as elevated oxygen concentration appear to help attain these goals in animal models (Mervin et al., 1999; Lewis et al., 1999; Sakai et al., 2001; Lewis et al., 2004).
11.参考文献
Aaberg TM。高氧是否限制视网膜脱离后的视网膜变性?中华眼科杂志1999;128:231。[PubMed]
Aigner L, Arber S, Kapfhammer JP, Laux T, Schneider C, Botteri F, Brenner HR, Caroni P.过度表达神经生长相关蛋白GAP-43诱导转基因小鼠成年神经系统神经发芽。细胞。1995;83:269 - 278。[PubMed]
安德森DH,费希尔SK,斯坦伯格RH。哺乳动物视锥细胞:盘脱落,吞噬和更新。投资眼科视觉科学1978;17:17 - 133。[PubMed]
灵长类动物中心凹锥体与色素上皮的关系。《超微结构杂志》1979;67:23-32。[PubMed]
Anderson DH, Stern WH, Fisher SK, Erickson PA, Borgula GA。视网膜脱离后色素上皮增生的发生。投资眼科视觉科学1981;21:10-16。[PubMed]
Anderson DH, Stern WH, Fisher SK, Erickson PA, Borgula GA。猫视网膜脱离:色素上皮-光感受器界面。投资眼科视觉科学1983;24:906-926。[PubMed]
Anderson DH, Gurin CJ, Erickson PA, Stern WH, Fisher SK.再附着视网膜的形态学恢复。投资眼科视觉科学。1986;27:168-183 .[PubMed]
阿拉姆特RB,塞勒MJ。视网膜片移植研究进展。Prog Retin Eye Res. 2004; 23:75 - 494。[PubMed]
Benowitz LI, Apostolides PJ, Perrone-Bizzozero N, Finkelstein SP, Zwiers H.生长相关蛋白GAP-43/B-50在成年大鼠大脑中的解剖分布。J > 1988; 8:339 - 352。[PubMed]
Benowitz LI, Perrone-Bizzozero NI。GAP-43在神经元生长和可塑性中的表达:何时、何地、如何以及为什么?学监大脑Res.1991; 89:69 - 87。[PubMed]
Benowitz LI, Perrone-Bizzozero NI。GAP-43与突触连接发育和可塑性的关系。Ann N Y Acad science . 1991; 627:58-74 .[PubMed]
Berglin L, Algvere PV, Seregard S.实验性视网膜脱离中感光细胞随时间的衰减和凋亡。中国眼科杂志1997;235:306-312。[PubMed]
大鼠视网膜中的穆勒放射状胶质细胞及其对损伤的反应。胶质纤维酸性蛋白(GFA)抗体免疫荧光研究。Exp Eye Res. 1979; 28:63-69。[PubMed]
家猫视网膜中双极细胞与光感受器之间的联系。中华神经科学杂志1973;148:91-114。[PubMed]
哺乳动物视网膜的平行处理:Proctor讲座。投资眼科视觉科学1999;40:1313-1327。[PubMed]
卡哈尔·s·雷蒙和La r tine des br . cellle。1892;9:19 19 - 225。
张长春,赖伟伟,张德平,曹茂华。人视网膜脱离后光感受器细胞凋亡的研究。角膜切削。1995;113:880 - 886。PubMed]
Chu Y, Humphrey MF, IJ警员。正常和营养不良大鼠视网膜的水平细胞:使用免疫标记28 kDa钙结合蛋白的大量研究。Exp Eye Res. 1993; 57:41 - 148。[PubMed]
Coblentz FE, Radeke MJ, Lewis GP, Fisher SK。神经节细胞对视网膜脱离反应的证据。Exp Eye Res. 2003; 76:333-342。[PubMed]
王晓燕,李晓燕,王晓燕,等。实验性视网膜脱离中光感受器凋亡的发生。投资眼科视觉科学。1995;36:990-996 .[PubMed]
De la Monte SM, Federoff HJ, Ng SC, Grabczyk E, Fishman MC.发育过程中GAP-43基因的表达:在成熟中枢神经系统的一组独特神经元中持续存在。Brain Res Dev Brain Res. 1989; 46:161-168。[PubMed]
兔和猫视网膜水平细胞的突触。科学。1966;153:1639 - 1641。[PubMed]
道林我。脊椎动物视网膜的组织角膜切削投资。1970;9:655 - 680。[PubMed]
艾森菲尔德AJ,邦特-米拉姆AH,萨蒂PV。大鼠视网膜遗传和实验光感受器变性后Muller细胞中胶质纤维酸性蛋白的表达。投资眼科视觉科学1984;25:1321-1328。[PubMed]
工程师,DeArmond SJ1981.胶质纤维酸性(GFA)蛋白免疫细胞化学的发展和神经病理学。第十一届国际解剖学大会,A部分;神经胶质和神经元细胞生物学。阿科斯塔·维德里奥,E. &费多罗夫,A,(编)。Liss,纽约,第65-79页。
伊诺克JJ。theretinal受体的光学特性。中国科学。1963;53:71-85。
Erickson PA, Fisher SK, Anderson DH, Stern WH, Borgula GA。猫视网膜脱离:外核层和外丛状层。投资眼科视觉科学1983;24:27 - 942。[PubMed]
Erickson PA, Fisher SK, Gurin CJ, Anderson DH, Kaska DD.视网膜脱离后Muller细胞中胶质纤维酸性蛋白增加。Exp眼睛Res.1987; 44:37-48。[PubMed]
Fariss RN, Molday RS, Fisher SK, Matsumoto B.来自正常和退行性光感受器的证据表明,两种外段整体膜蛋白具有不同的运输途径。中华神经科学杂志1997;387:148-156。[PubMed]
Fariss RN, Li ZY, Milam AH。色素性视网膜炎患者的视杆光感受器、分泌细胞和水平细胞异常。是J Ophthalmol.2000; 129:215 - 223。[PubMed]
Faude F, Francke M, Makarov F, Schuck J, Gartner U, Reichelt W, Wiedemann P, Wolburg H, Reichenbach A.实验性视网膜脱离引起兔视网膜广泛的多层变性。J Neurocytol。2001;30:379 - 390。[PubMed]
Fischer AJ, Reh TA。穆勒胶质细胞是鸡出生后视网膜神经再生的潜在来源。Nat > 2001; 4:247 - 252。[PubMed]
Fischer AJ, Reh TA。穆勒细胞成为神经源性再生视网膜祖细胞的潜力。神经胶质。2003;43:70 - 76。[PubMed]
Fisher SK, Boycott BB。猫和兔视网膜外丛状层水平细胞的突触连接。生物科学学报1974;186:317-331。[PubMed]
费雪SK,斯坦伯格RH。猫视网膜色素上皮顶端凸出到视锥细胞的起源和组织。中华神经科学杂志1982;206:131-145。[PubMed]
Fisher SK, Erickson PA, Lewis GP, Anderson DH。视网膜脱离引起的视网膜内增殖。投资眼科视觉科学1991;32:1739-1748 .[PubMed]
费雪SK,安德森DH。脱离对神经视网膜和视网膜色素上皮细胞的影响。在:瑞安SJ,威尔金森CP,编辑。视网膜手术retina.Vol。3.第三版。圣路易斯(密苏里州):莫斯比;2001.
Freed MA, Bsmith RG, Sterling P.猫视网膜中的棒双极阵列:来自棒和积聚gaba的无分泌细胞的输入模式。J Comp Neurol.1987; 266:445 - 455。[PubMed]
Geller SF, Lewis GP, Anderson DH, Fisher SK.使用MIB-1抗体检测视网膜中的增殖细胞。投资眼科视觉科学1995;36:737-744。[PubMed]
Geller SF, Lewis GP, Fisher SK.视网膜脱离后FGFR1信号和AP-1表达:反应性Muller和RPE细胞。投资眼科视觉科学2001;42:1363-1369。[PubMed]
Gispen WH, Nielander HB, De Graan PN, Oestreicher AB, Schrama LH, Schotman p生长相关蛋白B-50/GAP-43在神经元可塑性中的作用。摩尔一般。1991;5:61 - 85。[PubMed]
王晓燕,王晓燕,王晓燕。灵长类动物黄斑的视网膜再植:短期脱离后光感受器的恢复。投资眼科视觉科学1989;30:1708-1725。[PubMed]
Haley TL, Pochet R, Baizer L, Burton MD, Crabb JW, Parmentier M, Polans AS。人视锥细胞钙结合蛋白D-28k免疫反应性随视网膜位置的不同而不同。Vis > 1995; 12:301 - 307。[PubMed]
Immel J, Negi A, Marmor MF。兔视网膜脱离后RPE顶端形态的急性改变。扫描电镜研究。投资眼科视觉科学1986;27:1770-1776。[PubMed]
Jacobs GH, Calderone JB, Sakai T, Lewis GP, Fisher SK.In: Mollon JD, Pokorny J, Knoblauch K,编辑。正常和有缺陷的色觉。视网膜脱离对动物模型S锥和M锥功能的影响。牛津(英国):牛津大学出版社;2003.p . 381 - 388。
John SK, Smith JE, Aguirre GD, Milam AH。色素性视网膜炎视紫红质突变体视网膜锥体分子标记的丢失。摩尔粘度2000;6:204 - 215。PubMed]
Johnson LV, Hageman GS, Blanks JC。光感受器间基质结构域包裹脊椎动物锥体光感受器细胞。投资眼科视觉科学1986;27:129-135。[PubMed]
约翰逊PT,威廉姆斯RR,库萨托K,里斯BE。在发育过程中,杆状和锥状突起到内丛状层。中华神经科学杂志1999;414:1-12 .[PubMed]
Kapfhammer JP, Christ F, Schwab ME。大鼠视网膜发育过程中GAP-43和突触素的表达。Brain Res Dev Brain Res. 1994; 80:251-260 .[PubMed]
科恩斯JM,欣斯曼EJ。坐骨神经切除术的神经胶质反应。2电子显微镜。中华神经科学杂志1973;151:255-280。[PubMed]
猫视网膜中水平细胞与光感受器之间的联系:高尔基体制剂的电子显微镜。J Comp Neurol.1974; 155:1-14。[PubMed]
Kolb H, Famiglietti EV。猫视网膜上的杆状和锥状通道。角膜切削投资。1976;15:935 - 946。
猫视网膜的无分泌细胞、双极细胞和神经节细胞:高尔基体研究。视觉研究》1981;21:1081 - 1114。[PubMed]
王晓燕,王晓燕,王晓燕。脊椎动物视网膜的细胞组织。作者:Kolb H, Ripps H, Wu S,编辑。掠夺。大脑研究》131。视网膜生物学的概念和挑战。向约翰·e·道林致敬。阿姆斯特丹:爱思唯尔;2001.3-26页。
猫头鹰猴视网膜脱离的实验研究。3视网膜和色素上皮的电子显微镜。是J Ophthalmol.1968; 66:410 - 427。[PubMed]
猫头鹰猴视网膜脱离的实验研究。五、再植视网膜的电镜。Am J Ophthalmol. 1969; 67:117-130 .[PubMed]
猕猴视网膜脱离与再植的实验研究。眼科杂志。1969;68:58-77。[PubMed]
Kruger L, Bendotti C, Rivolta R, Samanin R.成年大鼠脑内GAP-43 mRNA的分布。中华神经科学杂志1993;333:417-434。[PubMed]
Kryger Z, Galli-Resta L, Jacobs GH, Reese BE。地鼠视网膜中杆状和锥状感光体的地形。Vis > 1998; 15:685 - 691。[PubMed]
Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR.机械张力可指定海马神经元轴突的命运。细胞生物学杂志,2002;159:499-508 .[PubMed]
Lewis GP, Erickson PA, Guerin CJ, Anderson DH, Fisher SK.视网膜脱离过程中特异性Muller细胞蛋白表达的变化。Exp Eye Res. 1989; 49:93-111。[PubMed]
Lewis GP, Erickson PA, Anderson DH, Fisher SK.实验性视网膜脱离后视蛋白在光感受器中的分布和蛋白质合并。Exp Eye Res. 1991; 53:629-640。[PubMed]
张志强,张志强,张志强,等。视网膜脱离诱导视网膜变性过程中细胞骨架蛋白组织的变化。投资眼科视觉科学1995;36:2404-2416。[PubMed]
Lewis GP, Linberg KA, Fisher SK.实验性视网膜脱离后双极和水平细胞的神经突生长。投资眼科视觉科学1998;39:424-434。[PubMed]
林伯格·卡,盖勒·SF,葛林·CJ, Fisher SK.神经营养因子BDNF在视网膜脱离实验模型中的作用。投资眼科视觉科学1999;40:1530-1544。[PubMed]
Lewis GP, Sethi CS, Charteris DG, Leitner WP, Linberg KA, Fisher SK.视网膜快速再附着阻止或逆转脱离引起的细胞和分子事件的能力。投资眼科视觉科学2002;43:2412-2420。[PubMed]
Lewis GP, Sethi CS, Linberg KA, Charteris DG, Fisher SK。实验性视网膜再植。一个新的视角。摩尔一般。2003;28:159 - 175。[PubMed]
Lewis GP, Fisher SK, 2003。GFAP在视网膜损伤中的上调:其在胶质重塑中的潜在作用及其与vimentin表达的比较。署名:全K.W.,编辑Int。启Cytol。细胞生物学概论。卷》230。圣地亚哥(加州):爱思唯尔学术出版社;2003.p . 263 - 290。
Lewis GP, Talaga KC, Linberg KA, Avery RL, Fisher SK.延迟氧疗治疗实验性视网膜脱离的疗效。中华眼科杂志2004;137:1085-1095。[PubMed]
李国强,黄志强,黄志强。视网膜脱离后的小胶质细胞激活:物种间的比较。摩尔粘度2005PubMed]
Li ZY, Kljavin IJ, Milam AH。色素性视网膜炎中的杆状光感受器神经突起。J > 1995; 15:5429 - 5438。[PubMed]
Liem AT, Keunen JE, van Meel GJ, van Norren D.黄斑受累视网膜脱离术后的连续性中心凹密度测量与视觉功能。1994; 101:1945 - 1952。[PubMed]
王晓燕,王晓燕,王晓燕(2001)。夜行性和昼行性哺乳动物眼睛主要视网膜通路的比较解剖学。作者:Kolb H, Ripps H, Wu S,编辑。视网膜生物学的概念和挑战。向约翰·e·道林致敬。大脑科学进展第131号决议:27-52。
Linberg KA, Lewis GP, Shaaw C, Rex TS, Fisher SK.正常和实验分离猫视网膜S-和m -锥的分布。J Comp Neurol.2001; 430:343 - 356。[PubMed]
王晓燕,王晓燕,王晓燕。鼠视网膜脱离的形态学和免疫细胞化学研究。Vis > 2002; 19:603 - 619。[PubMed]
林柏林,李志刚,李志刚,李志刚,李志刚,李志刚。再附着视网膜中锥体基质鞘和s锥体恢复的定量研究。投资眼科视觉科学2002;43:ARVO e -摘要4536。
Linberg k.a., Lewis g.p., Carter k.m., Fisher S.K.。免疫细胞化学证据表明,b型水平细胞轴突终末在猫视网膜脱离的反应中重构。投资眼科视觉科学2004;45:ARVO e -摘要4604。
正常和脱离视网膜中感光细胞对脉络膜的代谢依赖。投资眼科科学2000;41:3117-3123。[PubMed]
黄文华,张文华。美国加利福尼亚地鼠光感受器和神经节细胞的分布。J Comp Neurol.1983; 221:329 - 340。[PubMed]
猫头鹰猴的实验性视网膜脱离。再植的视网膜。眼科杂志。1968;66:1075-1091。[PubMed]
Marc RE, Murry RF, Fisher SK, Linberg KA, Lewis GP。分离猫视网膜的氨基酸特征。投资眼科视觉科学1998;39:1694-1702 .[PubMed]
Marc RE, Jones BW, Watt CB, Strettoi E.视网膜变性的神经重塑。Prog Retin Eye Res. 2003; 22:7 - 655。[PubMed]
几种物种成年视网膜中的gap -43样免疫反应性。大脑研究》1991;554:321 - 324。[PubMed]
海马锥体而非颗粒细胞中F1/(GAP-43) mRNA的选择性表达。Neuroscience.1991; 45:721 - 733。[PubMed]
Mervin K, Valter K, Maslim J, Lewis GP, Fisher SK, Stone J.限制视网膜脱离期间的死亡和解构:氧补充的价值。中华眼科杂志1999;128:155-164。[PubMed]
Migdale K, Herr S, Klug K, Ahmad K, Linberg K, Sterling P, Schein S猕猴,人和猫的杆状光感受器的两个带状突触单位。中华神经科学杂志2003;455:100-112。[PubMed]
一些脊椎动物视网膜中的多巴胺细胞和杆状双极细胞含有蛋白激酶c样免疫反应性。> Lett.1988; 94:247 - 252。[PubMed]
王晓燕,王晓燕,王晓燕。具有独立树突状系统的猫视网膜水平细胞。科学。1975;189:137 - 139。[PubMed]
王晓燕,王晓燕,王晓燕。视网膜脱离中蓝视锥和蓝视杆的选择性丧失。角膜切削。1995;113:1066 - 1073。[PubMed]
Nour M, Quiambao AB, Peterson WM, Al-Ubaidi MR, Naash MI. P2Y2受体激动剂INS37217增强正常和rds小鼠视网膜下注射引起的视网膜下穿刺后的功能恢复。投资眼科视觉科学2003;44:4505-4514。[PubMed]
Pasteels B, Rogers J, Blachier F, Pochet R.不同物种视网膜中的Calbindin和calretinin定位。Vis > 1990; 5:1-16。[PubMed]
凯乃酸诱导视网膜神经元萌发。科学。1984;223:503 - 504。[PubMed]
Pekny M, Johansson CB, Eliasson C, stayberg J, Wallen A, Perlmann T, Lendahl U, Betsholtz C, Berthold C- h, Frisen J缺乏胶质纤维酸性蛋白和波形蛋白的小鼠中枢神经系统损伤的异常反应。细胞生物学杂志1999;145:503-514。[PubMed]
Reh TA, Tetzlaff W, Ertlmaier A, Zwiers H.大鼠视网膜B50/GAP-43表达的发育性研究。J一般。1993;24:949 - 958。[PubMed]
Rex TS, Fariss RN, Lewis GP, Linberg KA, Sokal I, Fisher SK.实验性视网膜脱离后光感受器分子表达的研究。投资眼科视觉科学2002;43:1234-1247。[PubMed]
Rodieck RW光碟。正确的做法:看到的第一步。第四章。桑德兰(MA): Sinauer Assoc, Inc.;1998.70页-87。
Rohrenbeck J, Wassle H, Boycott BB。猴子视网膜中的水平细胞:用抗钙结合蛋白抗体进行免疫细胞化学染色。神经科学杂志1989;1:407-420。[PubMed]
罗斯WH。黄斑脱落视网膜脱离后视力恢复。眼睛。2002;16:440 - 446。[PubMed]
瑞安SJ。增生性玻璃体视网膜病变的病理生理学处理。中华眼科杂志1985;100:188-193。[PubMed]
李文华,李文华,李文华。高氧对视网膜脱离的影响。眼科科学2001;42:3264-3273。[PubMed]
Sarthy V, Ripps h,视网膜穆勒细胞。正确的做法:布莱克莫尔C,编辑。视觉研究的观点。纽约:全会出版社;2001.
Schmitz F, Konigstorfer A, Sudhof TC。RIBEYE,突触带的一个组成部分:蛋白质的进化之旅提供了对突触带功能的洞察。神经元。2000;28:857 - 872。[PubMed]
Sethi CS, Lewis GP, Fisher SK, Leitner WP, Mann DL, Luthert PJ, Charteris DG。增生性玻璃体视网膜病变视网膜脱离的胶质重建和神经可塑性。投资眼科视觉科学2005;46:32 29 - 342。[PubMed]
弧拱JH。轴突生长-蛋白质。Annu Rev Neurosci 1989; 12:27 - 156。[PubMed]
Steinberg RH, Reid M, Lacy PL.猫(猫科动物)视网膜中视杆和视锥的分布。中华神经科学杂志1973;148:229-248。[PubMed]
家猫视网膜锥体外节色素上皮细胞的包覆。生物学报。1974;187:461-478 .[PubMed]
斯坦伯格RH,伍德I,霍根MJ。人视网膜中央凹外视锥细胞色素上皮的包覆和吞噬作用。生物学杂志。1977;277:459-474。[PubMed]
斯坦伯格RH,费希尔SK,安德森DH。脊椎动物光感受器的圆盘形态发生。中华神经科学杂志1980;190:501-518。[PubMed]
斯泰尔斯WS,克劳福德BH。光线在不同点进入瞳孔时的发光效率。生物学报1933;112:428-450。
Strittmatter SM, Vartanian T, Fishman MC. GAP-43在神经元形成和修复中的可塑性蛋白。J一般。1992;23:507 - 520。[PubMed]
引用本文:Strittmatter SM, Fankhauser C, Huang PL, Mashimo H, Fishman MC.缺乏神经元生长锥蛋白gap -43的小鼠神经元寻径异常。1995; 80:445 - 452。[PubMed]
zel A, Takacs L, Monostori E, vhigh - teichmann I, Rohlich P.用杂交瘤上清定义的鸡光感受器的异质性。采用免疫研究。细胞组织Res. 1985; 240:735-741。[PubMed]
用抗视色素抗体鉴定哺乳动物视网膜中的蓝敏感锥体。J Comp Neurol.1988; 273:593 - 602。[PubMed]
灭霸S,摩尔S,洪y。视网膜小胶质细胞。Prog Retin Eye Res. 1996; 15:31 - 361。
Tropepe V, Coles BL, Chiasson BJ, Horsford DJ, Elia AJ, McInnes RR, van der Kooy D.成年哺乳动物眼睛中的视网膜干细胞。科学。2000;287:2032 - 2036。[PubMed]
瓦格纳H-J。Nannacara锥椎弓根突触带的数量变化:光依赖还是受昼夜节律控制?正确的做法:编辑阿里·马。鱼类的视觉:研究的新途径。1974年北约高级研究所。纽约:全会出版社;1975.p . 679 - 686。
瓦格纳H-J,阿里MA。不同实验条件下溪鳟(鲑科,鲑科)锥突触带和视网膜运动的变化。Can J Zool. 1977; 55:1684-1691。[PubMed]
瓦格纳H-J。鱼视网膜锥体蒂水平细胞末端形态的光依赖性可塑性。J Neurocytol。1980;9:573 - 590。[PubMed]
Wang Y, Macke JP, Merbs SL, Zack DJ, Klaunberg B, Bennett J, Gearhart J, nathan J.与人类阅读和绿色视觉色素基因相邻的位点控制区域。神经元。1992;9:429 - 440。[PubMed]
Wassle H, Yamashita M, Greferath U, Grunert U, Muller f。哺乳动物视网膜的杆状双极细胞。Vis > 1991; 7:99 - 112。[PubMed]
杨亮,Bula D, Arroyo JG,陈德芳。预防bax缺陷小鼠视网膜脱离相关光感受器细胞损失。《眼科科学》2004;45:648-654。[PubMed]
年轻的RW。感光细胞外节段的更新。细胞生物学杂志1967;33:61-72。[PubMed]
张宁。不同沟道类型对结构塑性的调节作用。J > 2002; 22:7065 - 7079。[PubMed]